
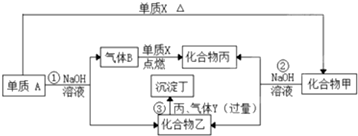
| A、CuS 不溶于强酸,FeS 可溶于强酸 |
| B、CuS 比FeS的溶解度更小 |
| C、H2S液中电离出的S2-浓度相当大 |
| D、转化成CuS是放热反应 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 2 |
| 3 |
| A、22.2% |
| B、28.2% |
| C、33.3% |
| D、37.8% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgCl和Ag2CrO4的溶解度相等 |
| B、AgCl的溶解度大于Ag2CrO4的溶解度 |
| C、两者类型不同,不能由Ksp的大小直接判断溶解能力的大小 |
| D、都是难溶盐,溶解度无意义 |
查看答案和解析>>
科目:高中化学 来源: 题型:
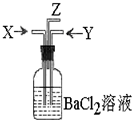 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法不正确的是( )
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法不正确的是( )| A、洗气瓶中产生的沉淀是碳酸钡 |
| B、Z导管出来的气体中含有二氧化碳 |
| C、气瓶中产生的沉淀是硫酸钡 |
| D、Z导管口有红棕色气体出现 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 操作 | 现象 |
| Ⅰ |  | 反应剧烈,试管中的黑色固体逐渐溶解,产生大量的无色具有臭鸡蛋气味的气体. |
| Ⅱ | 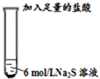 | 只有少量的无色臭鸡蛋气味的气体产生,但溶液中却有一定量的淡黄色沉淀产生. |
| 编号 | 操作 | 现象 |
| Ⅲ | 将H2S通入蒸馏水中达到饱和,将该溶液分为两等份.一份静置,另一份在空气中不断振荡. | 两份溶液在短时间内均未出现明显的浑浊现象. |
| 编号 | 操作 | 现象 |
| Ⅳ | 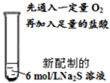 | 先通入一定量O2,几乎看不到明显变化;加入足量的盐酸,产生无色具有臭鸡蛋气味的气体,溶液中有大量的淡黄色沉淀产生. |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、赤铁矿的主要成分是Fe3O4 |
| B、铁与水蒸气在高温下的反应产物为Fe2O3和H2 |
| C、除去FeCl2溶液中的FeCl3杂质,向溶液中加入过量铁粉,过滤 |
| D、FeCl3与KSCN产生红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4Cl |
| B、NaOH |
| C、MgSO4 |
| D、NaNO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com