
分析 (1)纯碱为Na2CO3,是由金属离子和酸根离子构成的;
(2)酸碱反应的实质是氢离子和氢氧根离子反应,而酸与碳酸盐的反应为氢离子与碳酸根离子反应;
(3)铁、铝在常温下遇浓硝酸发生钝化;
(4)根据CO2+2NaOH═Na2CO3+H2O、CO2+NaOH═NaHCO3来分析可能的组成;
(5)将得到的固体重新溶解于水,在溶液中加过量的盐酸,使其充分反应后,再将溶液蒸干,得到固体的质量为NaCl,利用Na原子守恒可计算NaCl的质量.
解答 解:(1)因碱电离产生的阴离子全部为OH-,而纯碱是由金属离子和酸根离子构成,则纯碱属于盐,而不属于碱,故答案为:纯碱;
(2)酸碱反应的实质是H++OH-=H2O,酸与可溶性碳酸盐的反应的实质为2H++CO32-=CO2↑+H2O,
故答案为:H++OH-=H2O;2H++CO32-=CO2↑+H2O;
(3)因浓硝酸具有强氧化性,则Ag、Cu在常温下能全部溶于浓硝酸,而Fe、Al遇浓硝酸发生钝化,而不能全部溶解,故答案为:AB;
(4)由CO2+2NaOH═Na2CO3+H2O、CO2+NaOH═NaHCO3可知,二氧化碳的物质的量小于0.1mol时溶质为NaOH、Na2CO3,等于0.1mol时溶质只有Na2CO3,0.1mol<n(CO2)<0.2mol时溶液的溶质为Na2CO3、NaHCO3,n(CO2)≥0.2mol时,溶液的溶质只有NaHCO3,故答案为:NaOH、Na2CO3;Na2CO3、NaHCO3;
(5)将得到的固体重新溶解于水,在溶液中加过量的盐酸,使其充分反应后,再将溶液蒸干,得到固体为NaCl,由Na原子守恒可知,n(NaCl)=n(NaOH)=0.1mol,其质量为0.1mol×58.5g/mol=5.85g,故答案为:5.85g.
点评 本题考查物质的分类,熟悉根据物质的组成和性质得出的分类结果、物质的性质是解答本题的关键,并学会利用化学反应及守恒法来进行计算,难度不大.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
| A. | 5×10-13 mol•L-1 | B. | 0.02 mol•L-1 | ||
| C. | 1×10-7 mol•L-1 | D. | 1×10-12 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
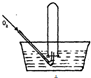 将体积为V mL的试管充满NO气体,按如图所示进行实验.当通入相同条件下O249mL时,液面仍在原来位置,则试管体积V为( )
将体积为V mL的试管充满NO气体,按如图所示进行实验.当通入相同条件下O249mL时,液面仍在原来位置,则试管体积V为( )| A. | 49mL | B. | 28 mL | C. | 30mL | D. | 24.5mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8倍 | B. | 12倍 | C. | 24倍 | D. | 64倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na2CO3产生的CO2多 | B. | NaHCO3产生的CO2多 | ||
| C. | NaHCO3的反应速率快 | D. | 二者产生CO2一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com