
 有一种瓦斯分析仪能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动.下列有关叙述正确的是( )
有一种瓦斯分析仪能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动.下列有关叙述正确的是( )| A. | 电极a是正极,电极反应式为CH4+4O2--8e-=CO2+2H2O | |
| B. | 电极b是正极,O2-由电极b流向电极a | |
| C. | 瓦斯分析仪工作时,电池内电路中电子由电极a流向电极b | |
| D. | 当电路中有0.4mol电子转移时,a极有2.24L(标况)甲烷放电 |
分析 瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动;通甲烷气体的为负极,通空气一端为正极,电池总反应为CH4+2O2=CO2+H2O,正极反应为:O2+4e-=2O2-,负极反应为:CH4+4O2--8e-=CO2+2H2O,结合原电池的原理和电极反应分析解答.
解答 解:A.甲烷所在电极a为负极,电极反应为:CH4+4O2--8e-=CO2+2H2O,故A错误;
B.该电池中a为负极,b为正极,O2-由b电极流向电极a,故B正确;
C.该电池中a为负极,b为正极,电子从负极流向正极,所以电池外电路中电子由电极a流向电极b,故C错误;
D.1mol O2得4mol电子生成2molO2-,故当固体电解质中有0.4mol电子转移时有0.05mol甲烷放电,体积为1.12L,故D错误;
故选B.
点评 本题考查新型电池,为高频考点,题目难度不大,注意把握原电池的工作原理以及电极反应式的书写,解答本题的关键是根据物质的性质判断原电池的正负极.


科目:高中化学 来源: 题型:选择题

| A. | a和b不连接时,铁片上会有金属铜析出 | |
| B. | a和b用导线连接时,碳棒上发生的反应为:Cu2++2e-═Cu | |
| C. | 无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色 | |
| D. | a和b分别连接直流电源正、负极,在电路中通过0.5mol电子后反接,又通过1mol电子,此时溶液中的c(H+)是2mol•L-1(假定溶液体积不变) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
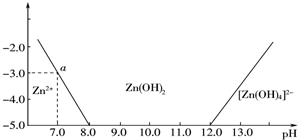
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
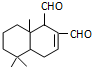
| A. | H2 | B. | Ag(NH3)2OH溶液 | C. | HBr | D. | Br2的CCl4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 戊烷、戊醇、戊烯、乙酸乙酯中同分异构体数目最少的是戊烯 | |
| B. | 分子式为C5H12O且可与金属钠反应放出氢气的有机化合物有8种 | |
| C. | 将2-丙醇与NaOH的醇溶液共热可制备CH3-CH=CH2 | |
| D. |  三种氨基酸脱水,最多可生成6种二肽 三种氨基酸脱水,最多可生成6种二肽 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用蒸馏分离有机物时,明火尽量与接液器保持一定距离 | |
| B. | 做焰色反应实验时,铂丝需要在硫酸中蘸洗 | |
| C. | 实验室制取氨气时,收集装置必须洗净但无需干燥 | |
| D. | 甲烷与氧气反应时,需要黑纸遮挡避免灯光照射 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自行车的钢圈上镀一层铬,防止生锈 | |
| B. | 外加直流电源保护钢闸门时,钢闸门与电源的负极相连 | |
| C. | 钢铁发生吸氧腐蚀的正极反应:2H2O+O2+4e-═4OH- | |
| D. | 钢铁发生析氢腐蚀的负极反应:Fe-3e-═Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
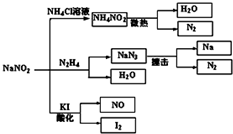 亚硝酸钠(NaNO2)是一种具有咸味、有毒,且价格比食盐(NaCl)便宜的工业用盐,常被误作食盐使用,导致多起中毒事故发生.它的部分性质如图,下列说法错误的是( )
亚硝酸钠(NaNO2)是一种具有咸味、有毒,且价格比食盐(NaCl)便宜的工业用盐,常被误作食盐使用,导致多起中毒事故发生.它的部分性质如图,下列说法错误的是( )| A. | 可用淀粉碘化钾试纸和食醋鉴别食盐(NaCl)与亚硝酸钠(NaNO2) | |
| B. | N2H4极易溶于水,因为它是极性分子且与水分子之间易形成氢键 | |
| C. | NaNO2与N2H4生成NaN3的反应方程式为:NaNO2+N2H4═NaN3+2H2O | |
| D. | 如图所涉及到的化学反应都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol•L-1 H2C2O4溶液:C(H+)>C(H2C2O4)>C(H2C2O4-)>C (C2O42-) | |
| B. | 常温下,pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合后所得溶液的PH<7 | |
| C. | 在(NH4)2SO4溶液中,C(NH4+)+C(NH3•H2O)=$\frac{1}{2}$C(SO42-) | |
| D. | 叠氮酸(HN3)与醋酸性相似,0.1 mol•L-1NaN3溶液:C (N3-)>C(Na+)>C(OH-)>C (H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com