
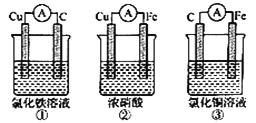
【题目】(1)为了验证Fe2+与Cu2+氧化性强弱,下列装置能达到实验目的的是______,写出正极的电极反应________。若构建原电池时两个电极的质量相等,当导线中通过0.05mol电子时,两个电极的质量差为________。
(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。

①实验测得OH-定问移向B电极,则_____处电极入口通甲烷(填A或B),其电极反应式为 ___________。
②当消耗甲院的体积为33.6L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为________。
【答案】③ Cu2++2e-=Cu 3g B CH4-8e-+10OH-=CO32-+7H2O 9.6mol
【解析】
(1)①中铜是负极,碳是正极,铁离子在正极放电生成亚铁离子,不能比较Fe2+与Cu2+氧化性强弱;
②中在常温下铁遇浓硝酸发生钝化,铁是正极,铜是负极,不能比较Fe2+与Cu2+氧化性强弱;
③中铁是负极,碳是正极,铜离子在正极得到电子生成铜,能比较Fe2+与Cu2+氧化性强弱,正极的电极反应为Cu2++2e-=Cu;
当导线中通过0.05mol电子时,消耗铁0.025mol×56=1.4g,析出铜是0.025mol×64g/mol=1.6g,则两个电极的质量差为1.4g+1.6g=3.0g;
(2)①实验测得OH-定向移向B电极,则B电极是负极,因此B处电极入口通甲烷,其电极反应式为CH4-8e-+10OH-=CO32-+7H2O;
②甲院的体积为33.6L(标准状况下),物质的量是1.5mol,假设电池的能量转化率为80%,则导线中转移电子的物质的量为1.5mol×80%×8=9.6mol。


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】自然界中的氧化铝晶体俗称刚玉,是一种坚硬的晶体。关于刚玉的下列说法中不正确的是
A.都是无色晶体B.熔点高难熔化
C.用于制造机械手表轴承D.用于制造中高档耐火材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产。下列说法中正确的是
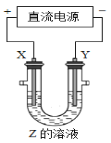
A. 氯碱工业中,X、Y均为石墨,Y附近能得到氢氧化钠
B. 铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4
C. 电镀工业中,X是待镀金属,Y是镀层金属
D. 外加电流的阴极保护法中,X是待保护金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从下列现象可以判断某一元酸是强酸的是 ( )
A.加热至沸腾也不分解B.该酸可以溶解石灰石放出CO2
C.该酸可以把Al(OH)3沉淀溶解D.该酸浓度为1mol/L时pH=0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,可采用还原法处理尾气中NO,其原理:2NO(g)+2H2(g)![]() N2(g)+2H2O(g) △H<0。在化学上,正反应速率方程式表示为v(正)=k(正)·cm(NO)·cn(H2),逆反应速率方程式表示为v(逆)=k(逆)·cx(N2)·cy(H2O),其中,k表示反应速率常数,只与温度有关,m,n,x,y叫反应级数,由实验测定。在恒容密闭容器中充入NO、H2,在T℃下进行实验,测得有关数据如下:
N2(g)+2H2O(g) △H<0。在化学上,正反应速率方程式表示为v(正)=k(正)·cm(NO)·cn(H2),逆反应速率方程式表示为v(逆)=k(逆)·cx(N2)·cy(H2O),其中,k表示反应速率常数,只与温度有关,m,n,x,y叫反应级数,由实验测定。在恒容密闭容器中充入NO、H2,在T℃下进行实验,测得有关数据如下:
实验 | c(NO)/mol·L-1 | c(H2)/mol·L-1 | v(正)/mol·L-1·min-1 |
① | 0.10 | 0.10 | 0.414k |
② | 0.10 | 0.40 | 1.656k |
③ | 0.20 | 0.10 | 1.656k |
下列有关推断正确的是
A. 上述反应中,反应物的总能量低于生成物的总能量
B. 若升高温度,则k(正)增大,k(逆)减小
C. 在上述反应中,反应级数:m=2,n=1
D. 在一定温度下,NO、H2的浓度对正反应速率影响程度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)工业上以粗铜为原料采取如下图所示流程制备硝酸铜晶体:

①在步骤a中,还需要通入氧气和水,其目的是___________________________。
②在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在____________范围。
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Fe3+ Cu2+ | 1.9 4.7 | 3.2 6.7 |
不用加水的方法调节溶液pH的原因是_______________________________________。
③进行蒸发浓缩时,要用硝酸调节溶液的pH=1,其目的是(结合离子方程式说明)
_________________________________________________________________________。
(2)工业上常利用硝酸铜溶液电镀铜,电镀时阴极的电极反应式是______________________。
(3)下图是某小组同学查阅资料所绘出的硝酸铜晶体[ Cu(NO3)2·nH2O ]的溶解度曲线(温度在30℃前后对应不同的晶体),下列说法正确的是__________(填字母)。

a.A点时的溶液为不饱和溶液
b.B点时两种晶体可以共存
c.按上述流程最终得到的晶体是Cu(NO3)2·3H2O
d.若将C点时的溶液降温至30℃以下,可以析出Cu(NO3)2·6H2O晶体
(4)某些共价化合物(如H2O、NH3、N2O4等)在液态时有微弱的导电性,主要是因为发生了电离,如:2NH3![]() NH
NH![]() +NH
+NH![]() ,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应。液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是______________________________________;Cu与液态N2O4反应制得无水硝酸铜的化学方程式是______________________________________。
,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应。液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是______________________________________;Cu与液态N2O4反应制得无水硝酸铜的化学方程式是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期律和元素周期表的论述中正确的是( )。
A.同一主族的元素从上到下金属性逐渐减弱
B.元素周期表是元素周期律的具体表现形式
C.同一周期从左到右,元素原子半径逐渐增大
D.非金属元素的最高正化合价等于它的负化合价的绝对值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10mL0.1 mol/L的醋醵溶液中逐滴加入等浓度的NaOH溶液,溶液中pH与pOH[pOH=-lgc (OH-)]的变化关系如图所示。则下列说法正确的是
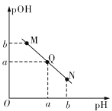
A. 两者恰好反应完全,需要NaOH溶液的体积大于10mL
B. Q点时溶液的pH=7
C. M点时溶液呈碱性,对水的电离起抑制作用
D. N点所示溶液中,c(CH3COO-)>c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是采用新能源储能器件将CO2转化为固体产物,实现CO2的固定和储能灵活应用的装置。储能器件使用Li-CO2电池,组成为:钌电极/CO2饱和的LiClO4-DMSO电解液/锂片。下列说法不正确的是
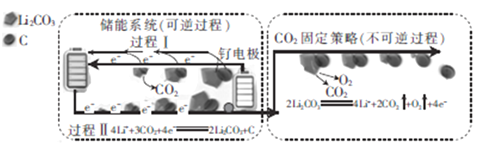
A. Li-CO2电池的电解液由LiClO4和DMSO溶于水得到
B. CO2的固定中,每转移8 mol e-,生成6 mol气体
C. 过程Ⅱ中化学能转化为电能
D. 过程Ⅰ的钌电极的电极反应式为2Li2CO3+C-4e-═4Li++3CO2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com