
| 淀粉-KI试纸检验气体 | 集气瓶收集氨气 | 容量瓶 |
| 应称量NaOH的质量/g | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它仪器 |
| 烧杯、玻璃棒、药匙 |
| n |
| V |
| n |
| V |


科目:高中化学 来源: 题型:
| A、镁和铝与同浓度的盐酸反应铝没镁反应剧烈,所以铝比镁的金属性强 |
| B、Mg(OH)2溶液的碱性比NaOH溶液的碱性弱,所以镁比钠的金属性强 |
| C、铁能从CuSO4溶液中置换出铜,所以铁比铜的金属性强 |
| D、电解含Ag+和Cu2+的溶液时,Ag+优先放电,所以银比铜的金属性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 实 验 步 骤 | 实 验 现 象 | 结 论 |
| 1.①将KSCN溶液滴入盛有FeCl2溶液的试管中,充分振荡 ②再滴入 | ① ②溶液变红 | Fe2+被Cl2氧化成Fe3+ |
| 2.①在盛有足量Fe粉的试管中滴入FeCl3溶液,充分振荡 ②再滴入KSCN溶液,充分振荡 | ①溶液由 色变为 ②无明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 液,试画出原电池的装置图,并说明其工作原理.
液,试画出原电池的装置图,并说明其工作原理.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
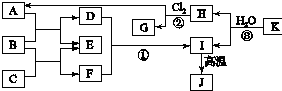 如图中,A、C是工业上用途很广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的能源、燃料,J是一种耐高温材料且是两性氧化物,K是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出).
如图中,A、C是工业上用途很广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的能源、燃料,J是一种耐高温材料且是两性氧化物,K是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com