
| 选项 | 实验操作 | 现象 | 结论 |
| A | 分别加热Na2CO3和NaHCO3固体 | 试管内壁都有水珠 | 两种物质均受热分解 |
| B | 加热盛有NH4Cl固体的试管 | 试管底部固体消失,试管口有晶体凝结. | NH4Cl固体可以升华 |
| C | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液 | 加入淀粉后溶液变成蓝色 | 氧化性:Cl2>I2 |
| D | 向FeSO4溶液中先滴入KSCN溶液再滴加H2O2溶液 | 加入H2O2后溶液变成血红色 | Fe2+既有氧化性又有还原性 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.碳酸钠加热不分解;
B.氯化铵加热分解,而升华为物理变化;
C.氯气可氧化碘离子,生成碘,淀粉遇碘变蓝;
D.亚铁离子被过氧化氢氧化.
解答 解:A.碳酸钠加热不分解,而碳酸氢钠加热分解生成水,结论不合理,故A错误;
B.氯化铵加热分解,而升华为物理变化,试管口HCl与氨气化合生成氯化铵,与升华无关,故B错误;
C.氯气可氧化碘离子,生成碘,淀粉遇碘变蓝,由氧化剂的氧化性大于氧化产物的氧化性可知氧化性:Cl2>I2,则实验操作、现象和结论均合理,故C正确;
D.亚铁离子被过氧化氢氧化,生成铁离子,遇KSCN溶液变为血红色,该实验体现亚铁离子的还原性,结论不合理,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应及现象、结论的分析为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)+c(HB-)+2c(H2B)=c(OH-) | B. | c(Na+)+c(OH-)=c(H+)+c(HB-) | ||
| C. | c(Na+)+c(H+)=c(OH-)+c(HB-)+c(B2-) | D. | 2c(B2-)+2c(HB-)=0.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应放出大量的热,甲烷可用作气体燃料 | |
| B. | 如温度超过100℃,反应前后气体的体积不变 | |
| C. | 可用干燥的冷烧杯检验生成的产物为CO2和H2O | |
| D. | 此式中使用箭头表示此反应主产物为CO2和H2O,还可能有其他副产物如CO、C等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
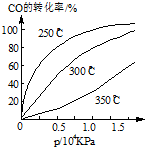 研究NO2、SO2.CO等大气污染气体的处理具有重要意义.
研究NO2、SO2.CO等大气污染气体的处理具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
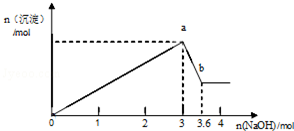 现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图.
现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
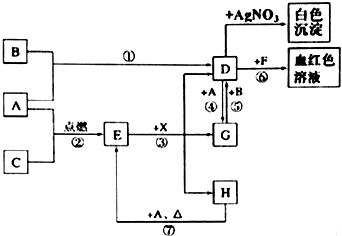
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 异常情况 | 可能原因分析 |
| A | 萃取:液体静置不分层 | 加入萃取剂的量较多 |
| B | 分液:分液漏斗中的液体难以滴下 | 没有打开分液漏斗活塞,或玻璃塞上凹槽与漏斗口侧面的小孔没有对齐 |
| C | 蒸馏:温度计读数达到了馏分的沸点且历时10分钟,锥形瓶中却无液体 | 温度计位置错误,或装置漏气,或冷凝水方向反了 |
| D | 检验Fe2+:加入KSCN溶液,溶液呈红色 | Fe2+已部分被氧化成Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{b-2c}{a}$ | B. | $\frac{2b-c}{a}$ | C. | $\frac{2b-2c}{a}$ | D. | $\frac{2b-4c}{a}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com