
| A.NA个Fe(OH)3胶体粒子的质量为107g |
| B.8.0 gCu2S和CuO的混合物中含有铜原子数为0.1NA |
| C.标准状况下,2.24 L Cl2溶于水中达到饱和,可得到HClO分子的数目是0.1NA |
| D.2.3gNa与氧气完全反应,反应中转移的电子数介于0.1 NA到0.2 NA之间 |
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源:不详 题型:填空题
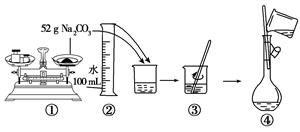
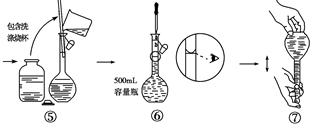
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.51% | B.56% | C.49% | D.10% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.托盘天平 | B.量筒 | C.500mL容量瓶 | D.胶头滴管 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.容量瓶蒸馏水洗后未加干燥 |
| B.量筒用蒸馏水洗后未干燥 |
| C.将烧杯中浓盐酸移入容量瓶后,未用水洗涤烧杯,即向容量中加水到刻度 |
| D.用胶头滴管向容量瓶中加水时,不慎超过刻度线,用另外胶头滴管从瓶中吸出部分溶液使剩余溶液刚巧达刻度线 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电解精炼铜时,若阴极得到电子数为2 NA,阳极质量减少64g |
| B.200mL某硫酸盐溶液中含有1.5 NA个SO42-离子,同时含有NA个金属阳离子,该盐物质的量浓度是2.5 mol/L |
| C.常温常压下,78g Na2O2固体中所含阴、阳离子总数为4 NA |
| D.一定条件下,足量的Fe粉与浓硫酸反应,转移电子数一定为2 NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com