
【题目】工业上可由乙苯生产苯乙烯,过程如图,下列说法正确的是( )
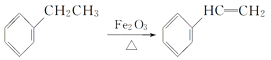 +H2
+H2
A.分子式为C8H10的芳香烃有三种结构
B.可用Br2/CCl4鉴别乙苯和苯乙烯
C.乙苯和苯乙烯分子中均含有碳碳双键
D.乙苯和苯乙烯分子内共平面的碳原子数均为7
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大。其中X与Y可形成一种淡黄色物质P,常温下将0.05 mol P溶于水,配成1 L溶液,其中![]() ;Z为金属元素,且Z可在W的一种氧化物中燃烧,生成一种白色的物质和一种黑色的物质。下列说法错误的是()
;Z为金属元素,且Z可在W的一种氧化物中燃烧,生成一种白色的物质和一种黑色的物质。下列说法错误的是()
A. 氢化物的沸点:W<X
B. 简单离子半径:X>Y>Z
C. 化合物P中既含有离子键又含有共价键
D. W、X、Y三种元素形成的物质的水溶液显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的叙述,正确的是( )
A. 与
与 互为同分异构体
互为同分异构体
B.O2和O3互为同位素
C.苯乙烯(![]() )所有原子一定在同一平面上
)所有原子一定在同一平面上
D.H2O和D2O化学性质相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 据Ksp(AgCl)=1.77×10﹣10,Ksp(Ag2CrO4)=2.0×10﹣12,可推知AgCl溶解度比Ag2CrO4的溶解度大
B. 处理水垢时常常先用碳酸钠溶液浸泡,再用酸溶解
C. 向碳酸钡沉淀中加入稀硫酸,沉淀发生转化,可推知硫酸钡的Ksp比碳酸钡的大
D. AgCl在10 mL 0.1 mol/L的KCl溶液中溶解的质量比在10 mL0.05mol/L的AgNO3溶液中多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Ksp[Mg(OH)2]=1.8×10-11 mol3·L-3,Ksp[Cu(OH)2]=2.2×10-20 mol3·L-3。向浓度为0.01 mol·L-1的Cu2+和Mg2+的混合溶液中逐滴加入NaOH溶液至过量,下列说法正确的是( )
A.较先出现的沉淀是Mg(OH)2
B.两种离子开始沉淀时,Cu2+所需溶液的pH较大
C.当两种沉淀共存时,说明溶液中完全不存在Cu2+、Mg2+
D.当两种沉淀共存时,溶液中![]() ≈8.2×108
≈8.2×108
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铜是制备其他含铜化合物的重要原料。有以下三种制备硫酸铜的途径,下列说法
不正确的是
途径①:Cu![]() CuSO4
CuSO4
途径②:Cu![]() CuSO4
CuSO4
途径③:Cu![]() CuSO4
CuSO4
A.途径①中浓硫酸体现强氧化性和酸性
B.途径①中,100g98%的浓H2SO4与足量铜反应,可得到80gCuSO4
C.途径②所用混酸中硝酸与硫酸物质的量之比最好为2:3
D.相对于途径①和途径②,途径③更好的体现了绿色化学的思想
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有些特殊的钢中含有Fe、C、Mn、V等元素,其中Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据如下表:
元素 | Mn | Fe | |
电离能(kJ/mol) | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
回答下列问题:
(1)Mn元素基态原子的价电子排布图为________。比较锰和铁两元素的电离能I2和I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难。对此,你的解释是:________________。
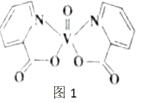
(2)钒元素的某种配合物可增强胰岛素降糖作用,它是电中性分子,结构如图1。分子中采取sp2杂化的原子有_________,1mol分子中含有配位键的数目是_____。
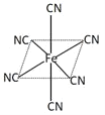
(3)铁元素广泛应用,Fe2+与KCN溶液反应得Fe(CN)2沉淀,KCN过量时沉淀溶解,生成黄血盐,其配离子结构如图![]() 离子所带电荷未标出
离子所带电荷未标出![]() 。
。
①已知CN-与N2结构相似,CN-的电子式是___________。
②化合物Fe(CO)5熔点为253K,沸点为376K,其固体属于____晶体。
③写出沉淀溶解的化学方程式_______________________________。
④图2的甲是Fe的一种晶胞,晶胞中Fe的堆积方式为___________,己知该晶体的密度为ρg/cm3用NA表示阿伏加德罗常数的值,则该晶胞的边长为___________cm。
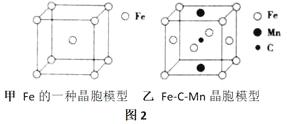
⑤图2的乙是Fe-C-Mn合金(晶体有缺陷)的一种晶胞,则与C原子等距紧邻Fe的个数为____________,该合金的化学式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镍及其化合物在合金材料以及催化剂等方面应用广泛。试回答下列问题:
(1)Ni2+电子排布中,电子填充的能量最高的能级符号为______。
(2)金属Ni能与CO形成配合物Ni(CO)4.与CO互为等电子体的一种分子为______(写化学式,下同),与CO互为等电子体的一种离子为______。
(3)丁二酮肟(![]() )是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。
)是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。
(4)丁二酮肟常与NI2+形成图A所示的配合物,图B是硫代氧的结果:

①A的熔、沸点高于B的原因为______。
②B晶体含有化学键的类型为______(填选项字母)。
A.σ键B.金属键C.配位键D.π键
(5)人工合成的氧化镍往往存在缺陷,某缺陷氧化银的组成为Ni0.97O,其中Ni元素只有+2和+3两种价态,两种价态的镍离子数目之比为______。
(6)Ni2+与Mg2+、O2-形成晶体的晶胞结构如图所示(Ni2+未画出),则该晶体的化学式为______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~辛等元素在周期表中的相对位置如图所示。甲与戊的原子序数相差3,戊是空气中含量最多的元素,丁与辛是同周期元素。下列说法正确的是( )

A.丙不能与水发生反应
B.己和氯气反应的产物只有一种
C.丙与庚的原子核外电子数相差13
D.乙形成的氧化膜疏松,不能保护内层金属
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com