
| A、抑制Fe2+的水解,用稀硝酸酸化 |
| B、提高高锰酸钾的氧化能力,用盐酸酸化 |
| C、检验SO42-时,用盐酸酸化 |
| D、检验Cl-时,用稀硫酸酸化 |


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
| A、已知甲烷的燃烧热为890.3 kJ?mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ?mol-1 |
| B、一定条件,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3放热19.3 kJ,则其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ?mol-1 |
| C、常温下反应C(s)+CO2(g)═2CO(g)不能自发进行是由于该反应△H>0 |
| D、已知25℃时,HCl(aq)和NaOH(aq)反应的中和热△H=-57.3 kJ?mol-1,则H2SO4(aq)和Ba(OH)2(aq)反应的中和热为△H=-114.6 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Zn(s)+CuSO4 (aq)=ZnSO4 (aq)+Cu(s);△H=-216kJ?mol-1,反应物总能量>生成物总能量 |
| B、相同条件下,如果1mol氢原子所具有的能量为E1,1mol氢分子所具有的能量为E2,则2E1=E2 |
| C、l0lkPa 时,2H2 (g)+O2 (g)=2H2O(1);△H=-571.6 kJ?mol-1,H2的燃烧热为571.6 kJ?mol' |
| D、H+ (aq)+OH-(aq)=H2O(l);△H=-57.3 kJ?mol-',含 1molNaOH 的氢氧化钠溶液与含0.5molH2SO4的浓硫酸混合后放出57.3kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学变化的实质是旧键的断裂和新键的生成,有物质变化但不一定有能量变化 |
| B、氢气的燃烧热为285.8kJ?mol-1,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l)△H=285.8kJ?mol-1 |
| C、Ba(OH)2?8H2O(s)+2NH4Cl(s)=BaCl2(s)+2NH3(g)+10H2O(l)△H<0 |
| D、已知中和热为57.3kJ?mol-1,若将含0.5molH2SO4的浓溶液与含1molNaOH的溶液混合,放出的热量要大于57.3kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③ | C、①④ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素性质 | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 氢化物的沸点(℃) | -60.7 | -33.4 | -111.5 | 100 | -87.7 | 19.54 | -84.9 | -161.5 |
| 最高化合价 | +6 | +5 | +4 | +5 | +7 | +4 | ||
| 最低化合价 | -2 | -3 | -4 | -2 | -3 | -1 | -1 | -4 |
查看答案和解析>>
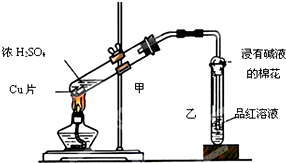
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,试根据下图所示的转化关系回答有关的问题(产物中生成的H2O等无机小分子均省略):
,试根据下图所示的转化关系回答有关的问题(产物中生成的H2O等无机小分子均省略):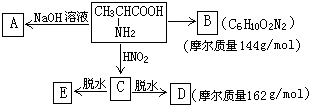
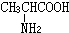 与
与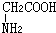 混合置于一反应容器中,一定条件下发生成肽反应,则最多生成
混合置于一反应容器中,一定条件下发生成肽反应,则最多生成查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com