
���� ��1�����ݸ�˹�������4CO��g��+2NO2��g��=N2��g��+4CO2��g���ķ�Ӧ�ȣ���Ӧ��3.36LCO��0.15molת��0.3mol���ӣ��������ʵ���֮�ȵ�������������ų���������
��2����֪��CH4��g��+4NO2��g��=4NO��g��+CO2��g��+2H2O��g����H1=-574KJ•mol-1��
��CH4��g��+4NO��g��=2N2��g��+CO2��g��+2H2O��g����H2=����
������ʽ��+�ڵ�2CH4��g��+4NO2��g��=2N2��g��+2CO2��g��+4H2O��g����H=��H1+��H2�����1molCH4��ԭNO2��N2�����������зų�������Ϊ867kJ���㣮
��� �⣺��1����CO��g��+NO2��g��=NO��g��+CO2��g����H=-a KJ•mol-1��a��0��
��2CO��g��+2NO ��g��=N2��g��+2CO2��g����H=-b KJ•mol-1��b��0��
������ʽ�١�2+�ڵ�4CO��g��+2NO2��g��=N2��g��+4CO2��g����H=��-a�� KJ•mol-1��2+��-b KJ•mol-1��=-��2a+b��KJ•mol-1
�������Ȼ�ѧ��Ӧ����ʽΪ��4CO��g��+2NO2��g��=N2��g��+4CO2��g����H=-��2a+b��KJ•mol-1��
���ݷ���ʽ֪ת�Ƶ��ӵ����ʵ���=$\frac{3.36L}{22.4L/mol}$��2=0.3mol���ų�������=$\frac{3.36L}{22.4L/mol}$��$\frac{��2a+b��kJ/mol}{4}$=$\frac{3��2a+b��}{80}$kJ��
�ʴ�Ϊ��0.3��$\frac{3��2a+b��}{80}$��
��2����CH4��g��+4NO2��g��=4NO��g��+CO2��g��+2H2O��g����H1=-574KJ•mol-1��
��CH4��g��+4NO��g��=2N2��g��+CO2��g��+2H2O��g����H2=����
������ʽ��+�ڵ�2CH4��g��+4NO2��g��=2N2��g��+2CO2��g��+4H2O��g����H=��H1+��H2��
���ݷ���ʽ֪��1mol CH4��ԭNO2��N2���������зų�������Ϊ867KJ�����ԡ�H2=-867KJ/mol��2-��-574KJ/mol��=-1160KJ/mol��
�ʴ�Ϊ��-1160KJ/mol��
���� ���⿼���˸�˹���ɵ��йؼ��㣬�����ø�˹������д����Ӧ��֮��Ĺ�ϵʽ�ǽⱾ��ؼ����Ѷ��еȣ�


 ���ɶ���ܲ��¿�ֱͨ�п�ϵ�д�
���ɶ���ܲ��¿�ֱͨ�п�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��һ�������ԭ���У��������������˶�״̬��ȫ��ͬ�ĵ��� | |
| B�� | ��һ�������ԭ���У�������������������ͬ�ĵ��� | |
| C�� | ��һ�������ԭ���У�N���ϵĵ��������϶���M���ϵĵ��������� | |
| D�� | ij�������ԭ�ӵ�3p�ܼ��Ͻ����������ӣ����ǵ�����״̬��Ȼ�෴ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | 11��16 | B�� | 6��8 | C�� | 12��17 | D�� | 20��9 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �� | B�� | �٢� | C�� | �ڢۢܢݢޢ� | D�� | �٢ۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | +8QkJ/mol | B�� | +16Q kJ/mol | C�� | -8Q kJ/mol | D�� | -16Q kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1 mol����ϩ���е�ԭ����ĿΪ6NA | |
| B�� | ��״���£�11.2L CHCl3�������е�ԭ������Ϊ2.5NA | |
| C�� | һ�������£�2.6 g��Ȳ��������̬�����������̼ԭ����Ϊ0.2NA | |
| D�� | 1 mol����1mol�ǻ�������������Ϊ10 NA�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
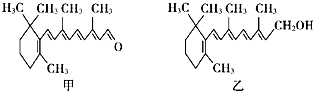
| A�� | �ӻ�ȩ�ķ���ʽΪC21H26O | |
| B�� | ά����A���ӽṹ�к��б�����̼̼˫�����ǻ� | |
| C�� | �ӻ�ȩ��ά����A���������� | |
| D�� | 1 mol��1 mol����һ�������¾��������6 mol H2������Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
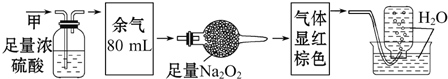
| A�� | NH3��NO2��N2 | B�� | NH3��NO��CO2 | C�� | NH3��NO2��CO2 | D�� | NO��CO2��N2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
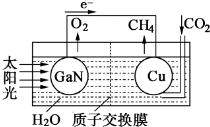
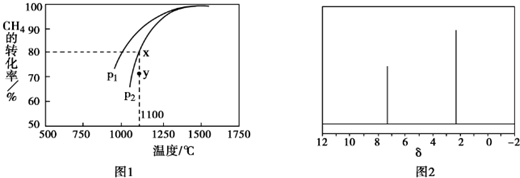
 ��
���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com