
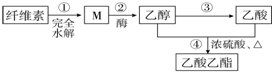
| A. | ③和④都发生了氧化还原反应 | |
| B. | M虽然分子结构中无醛基,但仍然可以发生银镜反应 | |
| C. | 步骤②,1molM完全反应可以生成3mol乙醇 | |
| D. | 若用淀粉替代纤维素,一定条件下也能按照此路线制备乙酸乙酯 |
分析 由制备流程可知,纤维素水解生成M为葡萄糖,M在酒精酶的作用下分解生成乙醇,乙醇氧化生成乙酸,④中乙酸、乙醇发生酯化反应生成乙酸乙酯.
A.④为酯化反应,③为氧化反应;
B.M为葡萄糖,含-OH、-CHO;
C.步骤2发生C6H12O6→2C2H5OH+2CO2;
D.淀粉水解可生成葡萄糖.
解答 解:由制备流程可知,纤维素水解生成M为葡萄糖,M在酒精酶的作用下分解生成乙醇,乙醇氧化生成乙酸,④中乙酸、乙醇发生酯化反应生成乙酸乙酯.
A.只有③为氧化反应,故A错误;
B.M为葡萄糖,含-OH、-CHO,含-CHO可以发生银镜反应,故B错误;
C.步骤2发生C6H12O6→2C2H5OH+2CO2,1molM完全反应可以生成2mol乙醇,故C错误;
D.淀粉水解可生成葡萄糖,用淀粉替代纤维素,一定条件下也能按照此路线制备乙酸乙酯,故D正确;
故选D.
点评 本题考查有机物的制备,为高频考点,把握有机物的性质、有机反应为解答的关键,侧重分析与应用能力的考查,注意有机物官能团与性质的关系,题目难度不大.


 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源:2016-2017学年安徽师大附中高二上10月月考化学卷(解析版) 题型:填空题
醇是重要的有机化工原料。一定条件下,甲醇可同时发生下面两个反应:
i .2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
ii.2CH3OH(g) C2H4(g)+2H2O(g)
C2H4(g)+2H2O(g)
I.上述反应过程中能量变化如图所示:
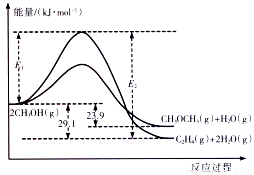
(1)在某密闭容器中,充入一定量CH3OH(g)发生上述两个反应,反应________(填“i”或“ii”)的速率较大,其原因为___________。若在容器中加入催化剂,使ii的反应速率增大,则E1和E2-E1的变化是:E1__________;E2-E1___________(填“增大”、“减小”或“不变”)。
(2)已知:CH3CH2OH(g)=CH3OCH3(g) ?ΔH =+50.7 kJ·mol-1。则乙烯气相直接水合反应C2H4(g)+H2O(g)=C2H5OH(g)的ΔH= 。
(3)若在容积为2 L的恒容密闭容器中发生i 、ii反应,当起始投料为2 mol CH3OH(g) 的消耗量为80%时容器中气体的平均相对分子质量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
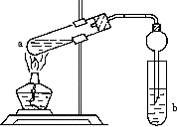 如图,在试管a中先加入2mL95%的乙醇,再加入3mL无水醋酸,边摇边缓缓加入2mL浓H2SO4,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入7mL饱和碳酸钠溶液.连接好装置.用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验.
如图,在试管a中先加入2mL95%的乙醇,再加入3mL无水醋酸,边摇边缓缓加入2mL浓H2SO4,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入7mL饱和碳酸钠溶液.连接好装置.用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
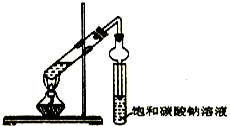 某同学用下列所示实验装置制取乙酸乙酯.回答以下问题:
某同学用下列所示实验装置制取乙酸乙酯.回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
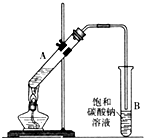 乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如图所示.有关数据及副反应:
乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如图所示.有关数据及副反应:| 乙酸 | 乙醇 | 乙酸乙酯 | C2H5OC2H5乙醚 | |
| 沸点/℃ | 118 | 78.3 | 77.1 | 34.5 |
| 溶解性 | 易溶于水 | 极易溶于水 | 与乙醚混溶 | 微溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种物质反应,不管怎样书写化学方程式,平衡常数不变 | |
| B. | 某温度下,2L密闭容器中加入4mol A和2mol B发生反应: 3A(g)+2B(g)?4C(s)+2D(g).平衡时测得n(C)=1.6mol,反应的化学平衡常数表达式为K=$\frac{{c}^{4}(C){c}^{2}(D)}{{c}^{3}(A){c}^{2}(B)}$ | |
| C. | 温度一定时,当溶液中c(Ag+)•c(Cl-)等于Ksp值时,此溶液为AgCl的饱和溶液 | |
| D. | 难溶电解质AB2饱和溶液中,c(A2+)=x mol•L-1,c(B-)=y mol•L-1,则Ksp值为4xy2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
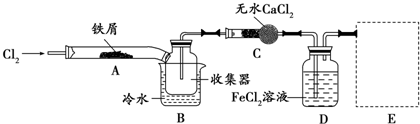
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | H-H | N三N | N-H |
| 键能/(kJ•mol-1) | 436 | 945.6 | 391 |
| A. | +192.4 kJ•mol-1 | B. | +92.4kJ•mol-1 | C. | -92.4kJ•mol-1 | D. | -192.4kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com