
已知:A、B、C、D四种短周期元素,其化合价最高正价数依次为1、4、5、7,已知B原子的核外次外层电子数为2。A、C原子的核外次外层电子数为8。D元素的最高价氧化物对应的水化物是已知含氧酸中酸性最强的酸。试回答下列有关的问题:
(1)写出C元素原子的价电子轨道表达式 ;D元素的价电子排布式 。
(2)已知B元素与氢元素形成的气态化合物在标准状况下的密度为1.161g·L-1,则在该化合物的分子中B原子的杂化方式为 。
(3)已知C、D两种元素形成的化合物通常有CD3、CD5两种。这两种化合物中一种为非极性分子,一种为极性分子,则属于极性分子的化合物的化学式是 。
(4)由B元素形成具有正四面体结构的晶体和由C元素形成具有正四面体结构的晶体相比,熔点较高的晶体是 (填写晶体的名称)。
(5)由A、D两元素形成的化合物组成的晶体中,阴、阳离子都具有或近似具有球型对称结构,它们都可以看作刚性圆球,并彼此“相切”。如下图所示为A、D形成化合物的晶胞结构图以及晶胞的剖面图:
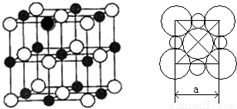 若
若
a=5.6×10-8cm,则该晶体的密度为 g·cm-3(精确到小数点后1位)。
(12分,每空2分) (1)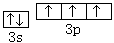 、3s23p5
、3s23p5
(2)sp (3)PCl3 (4)金刚石 (5)2.2
【解析】
试题分析:已知B的原子核外次外层电子数为2,最高正价为4,则B为碳元素;A、C原子的核外次外层电子数为8,最高正价分别为1、5,则A为钠元素,C为磷元素;D元素的最高价氧化物对应的水化物是已知含氧酸中最强的酸,该酸为高氯酸,且Cl的最高价为+7,所以D为氯元素。
(1)C为磷元素,最外层有5个电子,3s能级有2个电子,3p能级有3个电子,P原子的价电子轨道表示式为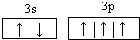 。D为氯元素,原子核外有17个电子,价电子排布式为3s23p5。
。D为氯元素,原子核外有17个电子,价电子排布式为3s23p5。
(2)B为碳元素,已知B与氢元素形成的化合物在标准状况下的密度为1.161g/L,该化合物的摩尔质量为1.161g/L×22.4L/mol=26g/mol,故该氢化物为C2H2。乙炔是直线型结构,C原子杂化轨道数为1+1=2,C原子的杂化方式为sp杂化。
(3)C为磷元素、D为氯元素,CD3、CD5分别为PCl3、PCl5。PCl5中心原子P原子最外层电子全部成键为非极性分子,PCl3中心原子P原子最外层电子未全部成键为极性分子,P原子呈3个σ键、含有1对孤对电子对,采取sp3杂化,空间结构为三角锥型。
(4)由B元素形成具有正四面体结构的晶体是金刚石,由C元素形成具有正四面体结构的晶体是白磷。金刚石是原子晶体,白磷是分子晶体,所以熔点较高的晶体是金刚石。
(5)在氯化钠晶胞中还有钠离子和氯离子的个数分别是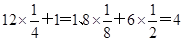 。由于晶胞的边长是=5.6×10-8cm,则该晶体的密度为
。由于晶胞的边长是=5.6×10-8cm,则该晶体的密度为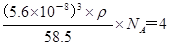 ,解得ρ=2.2 g/cm
,解得ρ=2.2 g/cm
考点:考查元素推断、核外电子排布规律、化学键、分子极性与空间结构、杂化轨道、沸点比较以及晶体结构和晶体的有关计算
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的应试能力和逻辑推理能力。该题以“周期表中元素的推断”为载体,比较全面考查学生有关元素推断知识和灵活运用知识的能力。考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:
 (2011?新余二模)化学--选修物质结构与性质
(2011?新余二模)化学--选修物质结构与性质查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 已知:A、B、C、D、E、F、X为周期表中前四周期的七种元素,它们的原子序数依次增大.A是周期表中原子半径最小的元素;B的基态原子有3个不同的能级,各能级中电子数相等;D的基态原子2p能级上的未成对电子数与B原子的相同;D2-离子与E2+离子具有相同的稳定电子层结构;F有“生物金属”之称,F4+离子和氩原子的核外电子排布相同;X的基态原子的价电子排布式为3d84s2.
已知:A、B、C、D、E、F、X为周期表中前四周期的七种元素,它们的原子序数依次增大.A是周期表中原子半径最小的元素;B的基态原子有3个不同的能级,各能级中电子数相等;D的基态原子2p能级上的未成对电子数与B原子的相同;D2-离子与E2+离子具有相同的稳定电子层结构;F有“生物金属”之称,F4+离子和氩原子的核外电子排布相同;X的基态原子的价电子排布式为3d84s2.

| 3 |
| ||
| 3 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知单质A、B、C、D有如下的反应关系.其中A 在B中燃烧时,火焰呈苍白色; C在B中燃烧时生成棕黄色的烟,E的水溶液呈蓝绿色,G是一种黑色固体.
已知单质A、B、C、D有如下的反应关系.其中A 在B中燃烧时,火焰呈苍白色; C在B中燃烧时生成棕黄色的烟,E的水溶液呈蓝绿色,G是一种黑色固体.
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com