
【题目】下列说法正确的是( )
A.化学反应的焓变与反应的途径有关
B.室温下,稀释0.1molL﹣1CH3COOH溶液,溶液的导电能力减弱
C.常温常压下,22.4L Cl2中含有的分子数为6.02×1023个
D.等质量的铜按a、b两种途径完全转化为Cu(NO3)2 , 途径a、b消耗的硝酸一样多![]()
【答案】B
【解析】解:A.焓变与反应的途径无关,与起始状态有关,故A错误;
B.CH3COOH溶液加水稀释,平衡向正反应方向移动,但离子浓度减小,导电能力减弱,故B正确;
C.不是标准状况,所以无法由22.4L 求物质的量,故C错误;
D.a中硝酸只作酸,b中硝酸作氧化剂和酸,则等量Cu制备硝酸铜时,b消耗的硝酸多,故D错误;
故选B.
【考点精析】根据题目的已知条件,利用反应热和焓变和弱电解质在水溶液中的电离平衡的相关知识可以得到问题的答案,需要掌握在化学反应中放出或吸收的热量,通常叫反应热;当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理.


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:
【题目】镁铝碱式酸盐[MgaAlb(OH)c(CO3)dxH2O]阻燃剂具有阻燃、消烟、填充等功能,是一种不溶于水的新型无机阻燃剂.
(1)将[MgaAlb(OH)c(CO3)dxH2O]表示成氧化物形式.
(2)为确定镁铝碱式碳酸盐的组成,进行如下实验:
准确称取15.050g样品进行灼烧至恒重,生成CO20.560L(已换算成标准状况下).分析测得残留物中MgO为6.000g,Al2O3为2.550g,通过计算确定该镁铝碱式碳酸盐的化学式 . (写出计算过程)
(3)该镁铝碱式碳酸盐可以由MgCl2、NaAlO2、NaOH和Na2CO3反应制备,制备的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题: 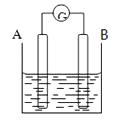
(1)若电流表的指针偏向B,则A为极,B为极
(2)若电流表G发生偏转,同时A极质量增加,B极质量减少,C为电解质溶液.则A、B、C分别为
A.A是Zn,B是Cu,C是稀硫酸
B.A是Cu,B是Zn,C是稀硫酸
C.A是Fe,B是Ag,C是稀AgNO3溶液
D.A是Ag,B是Fe,C是稀AgNO3溶液
(3)若电解质溶液是稀硫酸,按此图组装后,观察到A极不断的溶解,B极有气泡冒出,则A,B的金属性强弱为
(4)任何一个自发的氧化还原反应都可以设计为原电池,若该电池中发生的反应为:Fe+2FeCl3═3FeCl2 , A电极为铁,则B电极为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于过滤和蒸发的说法错误的是
A.过滤时漏斗下端须紧靠烧杯内壁
B.过滤时滤纸边缘要低于漏斗边缘
C.蒸发时要用玻璃棒不断搅拌液体
D.蒸发时将液体全部蒸干后停止加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】数十年来,化学工作者对碳的氧化物做了广泛深入的研究并取得了一些重要成果.如利用CO2和CH4重整可制合成气(主要成分为CO、H2),已知重整过程中部分反应的热化学方程式为:
I、CH4(g)═C(s)+2H2(g)△H=+75.0kJmol﹣1
II、CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41.0kJmol﹣1
III、CO(g)+H2(g)═C(s)+H2O(g)△H=﹣131.0kJmol﹣1
(1)反应CO2(g)+CH4(g)═2CO(g)+2H2(g)的△H=kJmol﹣1 .
(2)固定n(CO2)=n(CH4),改变反应温度,CO2和CH4的平衡转化率见图甲. 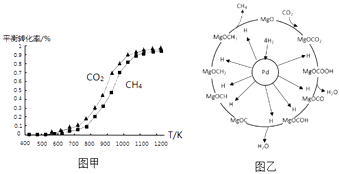
①同温度下CO2的平衡转化率(填“大于”或“小于”)CH4的平衡转化率,其原因是
②高温下进行该反应时常会因反应I生成“积碳”(碳单质),造成催化剂中毒,高温下反应I能自发进行的原因是 .
(3)一定条件下Pd﹣Mg/SiO2催化剂可使CO2“甲烷化”从而变废为宝,其反应机理如图乙所示,该反应的化学方程式为
(4)CO常用于工业冶炼金属,如图是在不同温度下CO还原四种金属氧化物达平衡后气体中lg[c(CO)/c(CO2)]与温度(t)的关系曲线图.下列说法正确的是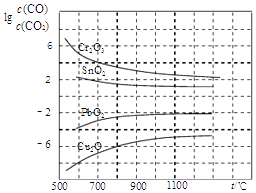
A.工业上可以通过增高反应装置来延长矿石和
CO接触的时间,减少尾气中CO的含量
B.CO不适宜用于工业冶炼金属铬(Cr)
C.工业冶炼金属铜(Cu)时较低的温度有利于
提高CO的利用率
D.CO还原PbO2的反应△H>0
(5)在载人航天器中应用电化学原理,以Pt为阳极,Pb(CO2的载体)为阴极,KHCO3溶液为电解质溶液,还原消除航天器内CO2同时产生O2和新的能源CO,总反应的化学方程式为:2CO2 ![]() 2CO+O2 , 则其阳极的电极反应式为 .
2CO+O2 , 则其阳极的电极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是除去括号内杂质的有关操作,其中正确的是
A.苯(苯酚)——加浓溴水,振荡静置分液
B.NO(NO2)——通过水洗、干燥后,用向下排气法收集
C.乙烷(乙烯)——让气体通过盛饱和溴水的洗气瓶
D.乙醇(乙酸)——加足量NaOH溶液,蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如图,回答下列问题: 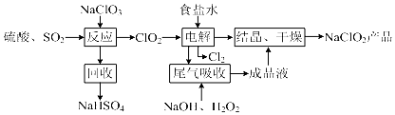
(1)ClO2的沸点为283K,纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下更安全.写出“反应”步骤中生成ClO2的化学方程式 .
(2)“尾气吸收”是吸收“电解”过程排出的少量ClO2 .
①在尾气吸收过程中,可代替H2O2的试剂是(填序号).
A.Na2O2B.Na2S C.FeCl2D.KMnO4
②提高尾气的吸收效率的可行措施有(填序号).
A.尾气吸收时充分搅拌吸收液B.适当加快尾气的通入速率C.将温度控制在20℃以下D.加水稀释尾气吸收液
③此吸收反应中,氧化剂与还原剂的物质的量之比为 .
(3)在碱性溶液中NaClO2比较稳定,在酸性溶液中,ClO2﹣和H+合为HClO2 , HClO2
是唯一的亚卤酸,不稳定,易分解产生Cl2、ClO2和H2O,写出HClO2分解的化学方程式: .
(4)已知NaClO2的溶解度随温度升高而增大,NaClO2饱和溶液在38℃以上60℃以下会析出NaClO2 , 在NaClO2析出过程中可能混有的杂质是(填化学式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃的分子式为C9H12,它不能使溴水通过化学反应褪色,可使酸性KMnO4溶液褪色,符合上述条件的烃有( )
A.8种B.7种C.6种D.5种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com