
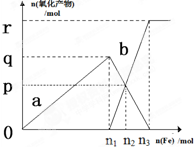
 含有4.0mol HNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物a、b与铁粉物质的量关系如图所示(还原产物只有NO).下列有关判断正确的是( )
含有4.0mol HNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物a、b与铁粉物质的量关系如图所示(还原产物只有NO).下列有关判断正确的是( )| A、a是Fe(NO3)2 |
| B、n1=0.80 |
| C、p=0.60 |
| D、n3=1.20 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠和铁 | B、镁和铜 |
| C、铝和镁 | D、锌和铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
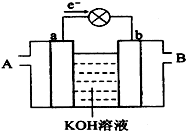 如图是水煤气(成分为CO、H2)空气燃料电池的工作原理示意图,a、b均为惰性电极.下列叙述中正确的是( )
如图是水煤气(成分为CO、H2)空气燃料电池的工作原理示意图,a、b均为惰性电极.下列叙述中正确的是( )| A、A处通入空气,B处通入水煤气 |
| B、a电极的反应式包括:CO+4OH--2e-=CO32-+2H2O |
| C、a电极发生还原反应,b电极发生氧化反应 |
| D、如用这种电池电镀铜,当镀件增重6.4g,则消耗标准状况下的水煤气4.48 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、阿司匹林具有解热镇痛作用 |
| B、可以用Si3N4、Al2O3制作高温结构陶瓷制品 |
| C、红宝石、珍珠、玛瑙、水晶、钻石等装饰品的主要成分都是硅酸盐 |
| D、石油裂解、煤的气化、海水制镁、纤维素制火棉等过程中都包含化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、弱电解质的电离达到平衡状态后,电离就停止了 |
| B、分子的消耗速率和离子的生成速率相等,说明弱电解质的电离达到平衡状态 |
| C、弱电解质的电离达到平衡状态后,分子和离子的浓度相等 |
| D、弱电解质的电离达到平衡状态后,外界条件改变,电离平衡可能要发生移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com