
A、B、C、D是中学化学常见的四种物质,它们的转化关系如下: A + B =" C" + D
(1)若A、B、C都是非金属氧化物,且C在空气中易变成A,则A中非氧元素的气态氢化物M的电子
式为 ;分子的稳定性B M(填“>”、“<”或“=”)
(2)若A、D是两种单质,B是黑色有磁性的氧化物,B与盐酸反应生成溶液N,检验N溶液中低价金属阳离子的方法是 。
将D的粉末加入溶液N中,当有28gD完全溶解时,该反应转移的电子是 mol。
(3)若A、B、C、D发生反应:2CO2(g) + 6H2(g) = CH3CH2OH(g) + 3H2O(g),根据下图所示信息,
①反应是 反应(填“放热”或“吸热”),判断依据是
②若△H =" a" KJ/mol,当消耗标况下5.6 L CO2时的反应热△H = KJ/mol。
③在恒温、恒容的密闭容器中,
下列描述能说明上述反应已达化学平衡状态的是 (填字母序号)。
A.生成1 mol CH3CH2OH的同时,生成3 mol H2O
B.容器中各组份的物质的量浓度不随时间而变化
C.容器中混合气体的密度不随时间而变化
D.容器中气体的分子总数不随时间而变化
(1)NH3的电子式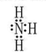 ,>
,>
(2)取反应后的溶液于试管中,滴加铁氰化钾溶液,溶液中有蓝色沉淀生成则含有Fe2;+或取反应后的溶液少量于试管中,滴加硫氰化钾,溶液不变红,再加新制氯水,溶液变红色,证明含有Fe2+;1
(3)①放热;反应物总能量高于生成物总能量 ② 0.125a ③ BD
解析试题分析:(1) C在空气中易变成A,气态氧化物中有NO空气中变成NO2,则C为NO,A为NO2,B为水,D为硝酸。M为氨气,电子式为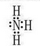 ,氧的非金属性强于氮,所以水的稳定性强于氨气,填“>”
,氧的非金属性强于氮,所以水的稳定性强于氨气,填“>”
(2) B是黑色有磁性的氧化物,B为四氧化三铁,与盐酸反应生成的低价金属阳离子是Fe2+,检验Fe2+的方法是取反应后的溶液少量于试管中,滴加铁氰化钾溶液,溶液中有蓝色沉淀生成则含有Fe2+,或取反应后的溶液少量于试管中,滴加硫氰化钾,溶液不变红,再加新制氯水,溶液变红色,证明含有Fe2+;D为单质铁,与N中的Fe3+反应生成Fe2+,28gFe溶解时,转移电子0.5mol×2=1mol
(3)①由图可知,反应物的总能量高于生成物的总能量,所以该反应为放热反应;
②△H =" a" KJ/mol,即2mol的CO2完全反应的热效应,标况下5.6LCO2的物质的量为0.25mol,其热效应为0.25/2×a KJ/mol="0.125a" KJ/mol
③A、反应的任何状态都有生成1 mol CH3CH2OH的同时,生成3 mol H2O,错误;B、容器中各组份的物质的量浓度不随时间而变化,符合化学平衡的特征,正确;C、恒容容器中密度始终不变,错误;D、随反应的进行,气体分子数在减少,当达到平衡时,不再减少,保持不变,正确,答案选BD。
考点:考查物质推断,气态氢化物的稳定性的比较,离子检验,电子式的书写,热效应的计算,化学平衡的判断


 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:填空题
有关FeSO4的转化关系如图所示(部分物质已略去)。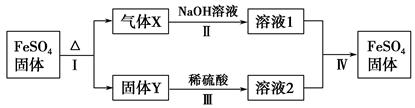
已知:①X由两种化合物组成,将X通入品红溶液,溶液退色;通入BaCl2溶液,产生白色沉淀。
②Y是红棕色的化合物。
(1)气体X的成分是(填化学式) 。
(2)反应Ⅰ的反应类型属于(填序号) 。
a.分解反应
B.复分解反应
c.置换反应
D.化合反应
e.氧化还原反应
(3)溶液2中金属阳离子的检验方法是 。
(4)若经反应Ⅰ得到16 g固体Y,产生的气体X恰好被0.4 L 1 mol·L-1 NaOH溶液完全吸收,则反应Ⅳ中生成FeSO4的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
取等物质的量的MgO和Fe2O3的混合物进行铝热反应,反应的化学方程式为 ,引发铝热反应的实验操作是 。进行铝热反应时,内层纸漏斗底部剪一小孔用水润湿的目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
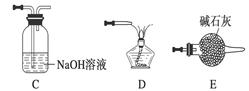
由冰铜(mCu2O·nFeS)冶炼得到粗铜,再以粗铜为原料制纯铜的流程如下: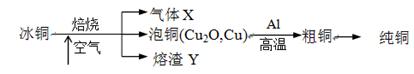
请回答下列问题:
(1)气体X是 。
(2)某研究性学习小组用熔渣Y与CO反应来制取Fe。
①请按气流由左到右的方向连接下列各装置,顺序为A→________。
②装置C的作用是________________。
③在点燃D处的酒精灯前,应进行的操作是__________________。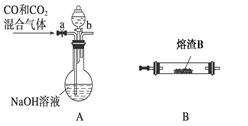
(3)熔渣Y中铁元素的价态有+2价和+3价,根据限选试剂,设计实验方案验证熔渣Y中有+2价铁元素存在,写出有关实验操作、预期现象与结论。
限选试剂: 3 mol·L-1H2SO4、6 mol·L-1HNO3、3% H2O2、0.01 mol·L-1KMnO4、20% KSCN。
。
(4)写出泡铜冶炼粗铜反应的化学方程式 。
(5)根据限选材料画出用粗铜提炼纯铜的装置图,并进行必要的标注。
限选材料:FeSO4(aq)、CuSO4(aq)、粗铁、纯铁、粗铜、纯铜、烧杯、直流电源、导线。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图中A—F均为中学化学中常见的物质,它们之间有如下转化关系。其中A、D 为金属单质。(反应过程中水及其他产物已略去) 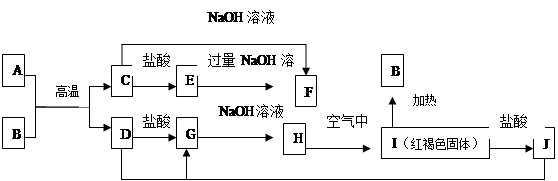
(1)C是 ,J是 (填化学式)。
(2)写出C与NaOH反应生成F的化学方程式
(3)A在常温下也可与NaOH溶液反应生成F,写出此反应的化学反应方程式 :
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
银铜合金广泛用于航空工业,从切割废料中回收银并制备铜化工产品的工艺如下:
(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450 ℃和80 ℃。)
(1)电解精炼银时,阴极反应式为________;滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学反应方程式为________________。
(2)固体混合物B的组成为__________;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为____________。
(3)完成煅烧过程中一个反应的化学方程式:
CuO+____Al2O3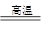 ____CuAlO2+________↑。
____CuAlO2+________↑。
(4)若银铜合金中铜的质量分数为63.5%,理论上5.0 kg废料中的铜可完全转化为________ mol CuAlO2,至少需要1.0 mol·L-1的Al2(SO4)3溶液________ L。
(5)CuSO4溶液也可用于制备胆矾,其基本操作是________、过滤、洗涤和干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图所示: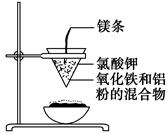
用两张圆形滤纸分别折叠成漏斗状,套在一起,使四周都有四层。把内层滤纸取出,在底部剪一个小孔,用水润湿,再跟另一纸漏斗套在一起,架在铁圈上,下面放置一盛沙的蒸发皿。把5 g干燥的氧化铁粉末和2 g铝粉混合均匀,放在纸漏斗中,上面加少量氯酸钾并在混合物中间插一根镁条,用小木条点燃镁条。观察发生的现象。通过以上实验信息,回答下列问题:
(1)写出该反应的化学方程式:__________,
在该反应中________是氧化剂,________是还原剂,该反应称为________反应。
(2)选出该实验的实验现象(填写在横线上):________。
①镁条剧烈燃烧;②放出大量的热,并发出耀眼的光芒,火星四射;③纸漏斗的下部被烧穿;④有红热状态的液珠落入蒸发皿内的细沙上,液珠冷却后变为黑色固体。
(3)写出下列操作或物质的作用:内层纸漏斗底部剪一个孔:________;蒸发皿盛沙:________;镁条:________;氯酸钾:________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号)________________。
(2)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质是(写分子式)____________。
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系:
A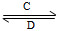 B(在水溶液中进行)
B(在水溶液中进行)
其中,C是溶于水显酸性的气体;D是淡黄色固体。写出C的结构式:________;D的电子式:________。
①如果A、B均由三种元素组成,B为两性不溶物,则A的化学式为________;由A转化为B的离子方程式为______________________________。
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因:______________________。A、B浓度均为0.1 mol·L-1的混合溶液中,离子浓度由大到小的顺序是________;常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铝广泛应用于化学工业和日常生活中。工业上由铝土矿(Al2O3·3H2O的含量约为85%,其余主要为SiO2、Fe2O3等)冶炼金属铝的流程如下。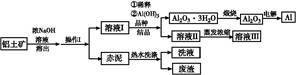
已知拜耳法生产Al2O3·3H2O的基本原理为:
Al2O3·3H2O+2NaOH(aq) 2NaAlO2(aq)+4H2O,[Al2O3·3H2O也可表示为2 Al(OH)3]
2NaAlO2(aq)+4H2O,[Al2O3·3H2O也可表示为2 Al(OH)3]
(1)操作Ⅰ的名称为 ,赤泥中除含有铝硅酸盐外,还含有的主要物质有 。
(2)为了提高铝土矿的溶出速率可采取的有效措施为 (任写三点)。
(3)用化学平衡理论解释稀释溶液Ⅰ有利于Al2O3·3H2O 结晶的原因 。
(4)为了析出Al2O3·3H2O,也可向溶液Ⅰ中通入过量CO2气体,写出生成Al2O3·3H2O的离子方程式: 。
(5)为了回收赤泥附着液带走的有用成分,工业上将用热水洗涤后的洗液用作溶液Ⅰ的稀释剂,请指出流程图中另一处类似的做法 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com