
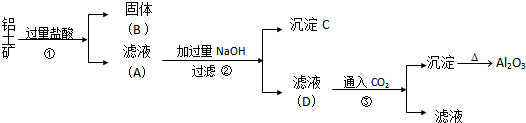
分析 铝土矿(主要成分为Al2O3、Fe2O3、SiO2)加入过量盐酸过滤得到氯化铝、氯化铁溶液,二氧化硅固体,滤液中加入过量的氢氧化钠,氯化铝反应生成偏铝酸钠溶液,氯化铁反应生成氢氧化铁沉淀,偏铝酸钠溶液通入二氧化碳生成氢氧化铝沉淀和碳酸氢钠溶液.
(1)分离固液用过滤;二氧化硅为酸性氧化物,能够与氢氧化钠反应生成硅酸钠和水;
(2)三价铁离子遇到硫氰酸根离子显血红色;
(3)依据反应中是否有化合价变化判断是否是氧化还原反应;偏铝酸钠与足量二氧化碳生成氢氧化铝和碳酸氢钠,与少量二氧化碳反应生成碳酸钠和氢氧化铝;
(4)依据氢氧化铁胶体的性质解答;
(5)依据电解氧化铝生成铝的方程式结合转移电子数计算参加反应氧化铝的质量.
解答 解:铝土矿(主要成分为Al2O3、Fe2O3、SiO2)加入过量盐酸过滤得到氯化铝、氯化铁溶液,二氧化硅固体,滤液中加入过量的氢氧化钠,氯化铝反应生成偏铝酸钠溶液,氯化铁反应生成氢氧化铁沉淀,偏铝酸钠溶液通入二氧化碳生成氢氧化铝沉淀和碳酸氢钠溶液;
(1)第一步在铝土矿中加入盐酸后得到氯化铝、氯化铁溶液和二氧化硅固体,分离二者用过滤方法;二氧化硅为酸性氧化物,能够与氢氧化钠反应生成硅酸钠和水,离子方程式:SiO2+2OH-=SiO32-+H2O,
故答案为:过滤;会;SiO2+2OH-=SiO32-+H2O;
(2)三价铁离子遇到硫氰酸根离子显血红色,可以用硫氰酸钾溶液检验三价铁离子的存在;
故答案为:硫氰酸钾溶液;溶液显血红色;
(3)铝土矿(主要成分为Al2O3、Fe2O3、SiO2)加入过量盐酸过滤得到氯化铝、氯化铁溶液,二氧化硅固体,滤液中加入过量的氢氧化钠,氯化铝反应生成偏铝酸钠溶液,氯化铁反应生成氢氧化铁沉淀,偏铝酸钠溶液通入二氧化碳生成氢氧化铝沉淀和碳酸氢钠溶液,该过程中发生的反应均为复分解反应,反应中没有化合价的变化,不属于氧化还原反应;偏铝酸钠溶液、氢氧化钠混合溶液通入过量的二氧化碳生成氢氧化铝沉淀和碳酸氢钠,碳酸氢钠与氢氧化钠反应生成碳酸钠和水;偏铝酸钠溶液、氢氧化钠混合溶液通入过量的二氧化碳生成氢氧化铝沉淀和碳酸氢钠,碳酸氢钠与氢氧化钠反应生成碳酸钠和水,离子方程式:AlO2-+CO2+2H2O=Al(OH)3+HCO3-;HCO3-+OH-═H2O+CO32-;
故答案为:否;AlO2-+CO2+2H2O=Al(OH)3+HCO3-;HCO3-+OH-═H2O+CO32-;
(4)将沉淀氢氧化铁与稀盐酸反应所得的物质氯化铁制成饱和溶液,滴入沸水中可得到以氢氧化铁为分散质的胶体,
a.氯化铁为黄色,故a错误;
b.胶体具有丁达尔效应,溶液不具有,故b错误;
c.溶液分散质粒度小于1nm,胶体介于1-100nm,故C错误;
d.溶液、胶体分散质粒度都小于滤纸孔径,都能够透过滤纸,故d正确;
故选:d;
(5)电解熔融氧化铝的方法制取金属铝,发生2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑,
2molAl2O3~~4molAl~~12mol电子
2 12
n 0.3mol
解得:n=0.05mol
氧化铝的质量=0.05mol×102g/mol=5.1g;
答:参加反应的氧化铝质量为5.1g.
点评 本题考查了铝的制备工艺流程,涉及离子方程式的书写、物质的分离、氧化还原反应的有关计算、离子的检验、胶体的性质等,题目综合性强,难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 原子序数:A>B>C>D | B. | 离子半径:A+>B2+>C->D2- | ||
| C. | 氢化物稳定性:H2D>HC | D. | 金属性:A>B |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学生欲通过实验方法验证Fe2+的性质.
某学生欲通过实验方法验证Fe2+的性质.| 实验操作 | 预期现象 | 反应的离子方程式 |
| 向盛有新制FeSO4溶液的试管中滴入数滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液颜色逐渐变黄 | Fe2++NO3-+2H+=Fe3++NO2+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以用淀粉溶液检验加碘盐中是否含碘元素 | |
| B. | 水晶、玛瑙的主要成分是二氧化硅 | |
| C. | “白色污染”是指由不可降解的塑料造成的环境污染 | |
| D. | 硫和氮的氧化物是形成酸雨的主要物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 产物B的状态只能为固态或液态 | |
| B. | 保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动 | |
| C. | 若开始时向容器中加入1molB和1molC,达到平衡时放出热量a KJ | |
| D. | 衡时,单位时间内n(A)消耗﹕n(C)消耗=1﹕1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 或NH2-NH-NH-NH-NH-NH2.
或NH2-NH-NH-NH-NH-NH2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液(NaHCO3),加入适量的NaOH溶液 | |
| B. | NaHCO3溶液(Na2CO3),通入过量的CO2气体 | |
| C. | CO2气体(HCl气体),通过饱和的Na2CO3溶液 | |
| D. | SiO2(H2SiO3),加热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com