
| A. | 该溶液-定含有Fe2+、Cl-、NO3- | B. | 该溶液一定不含Na+、NH4+、SO42- | ||
| C. | 该无色气体对环境无污染 | D. | 该溶液可能含有Ba2+ |
分析 一杯澄清透明的溶液中,加足量稀盐酸,有无色气体生成,且阴离子的种类不变,溶液一定不存在碳酸根离子,一定存在硝酸根离子、亚铁离子和氯离子,
再根据溶液电中性分析可能存在和一定不存在的离子.
解答 解:加足量稀盐酸,有无色气体生成,且阴离子的种类不变,说明溶液中一定存在氯离子、硝酸根离子和亚铁离子,一定不存在碳酸根离子,生成气体为NO,污染环境,
由溶液电中性,各离子的浓度相等,设氯离子、硝酸根离子都是0.1mol/L,带有负电荷为0.2mol/L,亚铁离子浓度为0.1mol/L,所带正电荷为0.2mol/L;
若存在硫酸根离子,溶液中一定存在钠离子和铵离子,但是一定不存在钡离子,若不存在硫酸根离子,一定不存在钠离子、铵离子和钡离子,
只有A正确.
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及知识点较多,侧重实验基本操作和物质推断的考查,把握混合物分离方法及操作、离子的检验及焰色反应等为解答的关键,注意实验操作的可行性、评价性分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 具有吸附性 | |
| B. | 溶解度大于CuS、PbS、CdS | |
| C. | 溶解度小于CuS、PbS、CdS | |
| D. | MnO2的氧化性强于Cu2+、Pb2+、Cd2+等金属离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
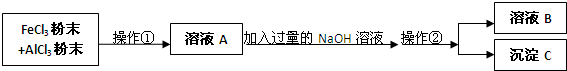
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3- NO3- OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将氯气与通入冷的消石灰中反应制漂白粉:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O | |
| B. | 向较浓的Na2SiO3溶液中滴加适量盐酸制得硅酸胶体:Na2SiO3+2HCl═2NaCl+H2SiO3(胶体) | |
| C. | 铁在潮湿的环境中生锈:3Fe+4H2O═Fe3O4+4H2↑ | |
| D. | 用氢氟酸刻蚀玻璃:SiO2+4HF═SiF4+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com