
| A.通过化合反应可制得FeCl2和Fe(OH)3 |
| B.铁是较活泼的金属,不能用铁质容器储存、运输浓硝酸、浓硫酸 |
| C.不锈钢是铁的合金,只含金属元素 |
| D.Fe3O4俗称铁红 |
 习题精选系列答案
习题精选系列答案科目:高中化学 来源:不详 题型:实验题

 、
、  、
、  、
、 

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

| A.KMnO4溶于水不放热,可以直接在容量瓶中溶解 |
| B.容量瓶洗涤后不需干燥即可直接用于实验 |
| C.定容后摇匀,凹液面低于刻度线,再加水至凹液面最低点与刻度线相平 |
| D.如果定容时加水超过刻度线必须毓配制 |
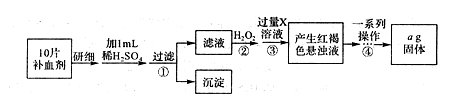
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
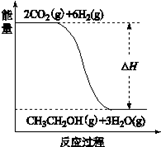
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.二氧化硅可用作半导体材料 | B.硝酸常用作金属铜加工前的酸洗 |
| C.碳酸钠可用于治疗胃酸过多 | D.三氧化二铁常用于生产红色油漆和涂料 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
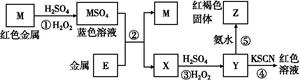
| A.E3+的氧化性比M2+的氧化性弱 |
| B.在反应①中硫酸既表现了酸性、又表现了氧化性 |
C.反应④的离子方程式可表示为:3SCN-+E3+ E(SCN)3↓ E(SCN)3↓ |
| D.在③反应中若不加稀硫酸可能看到红褐色沉淀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
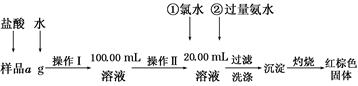
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
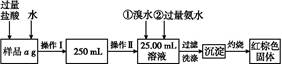
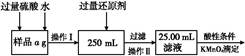
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe3O4是—种红棕色粉末,俗称磁性氧化铁 |
| B.铁与水蒸气在高温下的反应产物为Fe2O3和H2 |
| C.去除FeCl2溶液中的FeCl3杂质可以向溶液中加入过量铁粉,然后过滤 |
| D.Fe3+与KSCN反应产生红色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com