
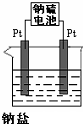
 已知下列反应(反应所需的其他条件和各物质的化学计量数均已略去):
已知下列反应(反应所需的其他条件和各物质的化学计量数均已略去):分析 (1)A+B $\frac{\underline{\;电解\;}}{\;}$M+D+E,E+M═A+F+B,所以第一个反应是电解饱和食盐水的反应,A为NaCl,B为H2O,M为NaOH,E为Cl2,D为H2,在工业上称为氯碱工业;把杂质转化为沉淀或气体除去,除钙离子用碳酸根离子,除镁离子、铁离子用氢氧根离子,除硫酸根离子用钡离子,要注意除杂质的顺序,后加的试剂最好能把前面先加是过量试剂除掉;25℃时、有pH为x的HCl溶液和pH为y的NaOH溶液,HCl和NaOH都是强电解质,如果HCl和NaOH恰好中和,则二者的物质的量相等,则有aL×10-xmol/L=bL×10y-14mol/L,即a:b=10x+y-14;
(2)可用于实验室中检验乙醇中水的存在,说明A是硫酸铜,电解时,生成铜、氧气、硫酸;
(3)原电池放电时,2Na+xS=Na2Sx,硫单质得电子,正极反应为:xS+2e-=Sx2-,负极电极反应为Na-e-=Na+;根据得失电子守恒建立关系式计算c(OH-).
解答 解:(1)A+B $\frac{\underline{\;电解\;}}{\;}$M+D+E,E+M═A+F+B,所以第一个反应是电解饱和食盐水的反应,A为NaCl,B为H2O,M为NaOH,E为Cl2,D为H2,在工业上称为氯碱工业,
除去粗盐中的可溶性杂质:Ca2+、Mg2+、Fe3+、SO42-时,加入过量BaCl2(去除硫酸根离子):SO42-+Ba2+=BaSO4↓;加入过量Na2CO3(去除钙离子的多余的钡离子):Ca2++CO32-=CaCO3,碳酸钠必须加在氯化钡之后;加入过量NaOH(去除镁离子和铁离子):Mg2++2OH-=Mg(OH)2↓,Fe3++3OH-═Fe(OH)3↓;过滤除掉沉淀,向滤液中加入适量盐酸至溶液呈中性(除掉溶液中过量的氢氧根和碳酸根),
25℃时、有pH为x的HCl溶液和pH为y的NaOH溶液,HCl和NaOH都是强电解质,如果HCl和NaOH恰好中和,则二者的物质的量相等,则有aL×10-xmol/L=bL×10y-14mol/L,即a:b=10x+y-14,若x+y>14,则a:b=10x+y-14>1,即a>b,
故答案为:氯碱工业;过量BaCl2、过量Na2CO3、过量NaOH、过滤后向滤液中加入适量HCl;10x+y-14;>;
(2)可用于实验室中检验乙醇中水的存在,说明A是硫酸铜,电解时,生成铜、氧气、硫酸,电解方程式为:2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4,
故答案为:2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4;
(3)原电池放电时,2Na+xS=Na2Sx,硫单质得电子,正极反应为:xS+2e-=Sx2-,负极电极反应为Na-e-=Na+,
电解氯化钠溶液时,原电池中钠失去电子总数与电解池中电子转移总数相等,当电池消耗23gNa时,失去电子为1mol,
2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑,2NaCl~2NaOH~2e-,而NaCl只有0.2mol,则只能生成氢氧化钠0.2mol,这部分电子转移为0.2mol,电池继续工作相当于电解水,2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,不影响氢氧化钠物质的量,则c(OH-)=$\frac{n(NaOH)}{V}$=$\frac{0.2mol}{2L}$=0.1mol/L,则PH=13,
故答案为:xS+2e-=Sx2-;13.
点评 本题考查了电解的原理和规律,结合反应的特点以及现象进行推断,涉及粗盐提纯过程中的除杂方面的知识,酸碱混合溶液定性判断及pH的有关计算,侧重考查学生分析计算能力,明确恰好反应时二者物质的量相等是解本题关键,综合性强,第(3)问后期是电解水,易错,注意审题.


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:选择题
| A. | 含氧酸的酸性:H3ZO4>H2YO4>HXO4 | |
| B. | 原子半径:Z>Y>X | |
| C. | 气态氢化物的稳定性按X、Y、Z顺序由弱到强 | |
| D. | 元素的负化合价的绝对值按X、Y、Z顺序由小到大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取代反应 | B. | 加成反应 | C. | 酯化反应 | D. | 氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2CO3?2H++CO32- | B. | HClO+H2O?H3O++ClO- | ||
| C. | NaHCO3?Na++HCO3- | D. | 在熔化时NaHSO4═Na++H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应物 | 溴水 | 酸性KMnO4溶液 | 氢硫酸(H2S溶液) | 滴有酚酞的NaOH溶液 | 石蕊试液 | 品红溶液 |
| 反应现象 | ||||||
| SO2的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
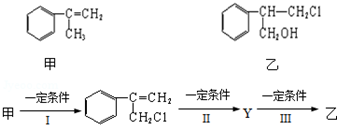
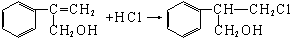 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 残留物只有Na2CO3 | |
| B. | 原混合气体中O2与CH4的物质的量之比为1﹕2 | |
| C. | 残留物只有NaOH | |
| D. | 原混合气体中O2和CH4的体积比为2﹕1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.
SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.| n(SO32-):,n(HSO3-) | 91:9 | 1:1 | 1:91 |
| PH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com