
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ。且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为( )
A.920 kJ B.557 kJ C.436 kJ D.188 kJ
科目:高中化学 来源: 题型:
下列关于电化学知识说法正确的是
A.电解AlCl3溶液,在阴极上析出金属Al
B.氢氧燃料电池中,氧气是正极反应物
C.用惰性电极电解CuSO4溶液一段时间,溶液酸性不变
D.铅蓄电池在充电时,连接电源正极的电极反应为:PbSO4+2e-=== Pb+SO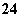
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏伽德罗常数的值。下列说法正确的是( )
A. 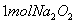 固体中含离子总数为
固体中含离子总数为
B. 常温下,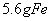 与足量稀
与足量稀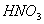 反应,转移
反应,转移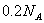 个电子
个电子
C. 常温常压下,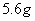 乙烯与丁烯的混合物中含有的氢原子的数目为
乙烯与丁烯的混合物中含有的氢原子的数目为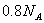
D. 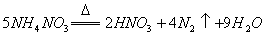 反应中,生成
反应中,生成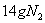 时,转移的电子数目为
时,转移的电子数目为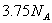
查看答案和解析>>
科目:高中化学 来源: 题型:
A~H均为有机化合物,它们之间的转化关系如图所示
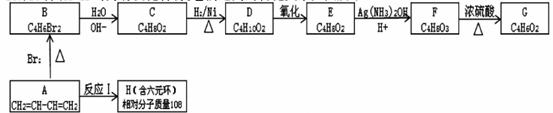
已知:①反应 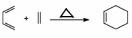
②E既能发生银镜反应,又能与金属钠反应放出氢气。
③核磁共振氢谱表明G分子中有三种氢,且其峰面积之比为1:1:1
(1)A的名称(系统命名法)____________________。
(2)B生成C的反应类型为____________________。
(3)D中含氧官能团的名称为____________________。
(4)由E生成F的第一步反应化学方程式为____________________。与F具有相同官能团的F的同分异构体还有__________种。(填数字)
(5)由A生成H的化学方程式为____________________。
(6)G的结构简式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定量的Ag2SO4固体置于容积不变的容器中,在某温度下发生下列反应:
Ag2SO4(s) Ag2O(s)+SO3(g) 2SO3(g)
Ag2O(s)+SO3(g) 2SO3(g) 2SO2(g)+O2(g)
2SO2(g)+O2(g)
经10分钟反应达到平衡,此时c(SO3)=0.4 mol/L,c(O2)=0.05 mol/L,下列叙述不正确的是( )
A.SO3的分解率为20% B.10分钟内ν(SO2)=0.01mol/(L·min)
C.容器内气体的密度为40g/L D.加压,容器内固体的质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应N2(g)+3H2(g) 2NH3(g),△H=-Q KJ/mol(Q>0)。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molN2和3molH2,在一定条件下达到平衡时放出热量为Q1KJ;在相同条件下,向乙容器中加入2molNH3达到平衡后吸收热量为Q2KJ,已知Q1=4Q2。下列叙述不正确的是( )
2NH3(g),△H=-Q KJ/mol(Q>0)。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molN2和3molH2,在一定条件下达到平衡时放出热量为Q1KJ;在相同条件下,向乙容器中加入2molNH3达到平衡后吸收热量为Q2KJ,已知Q1=4Q2。下列叙述不正确的是( )
A.达到平衡时,两容器中反应物的转化率不同
B. 达到平衡时,甲中NH3的体积分数与乙相等
C. 达到平衡后,再向乙中加入0.2moLN2、0.6molH2、1.6molNH3,平衡向生成NH3的方向移动
D.乙中的热化学反应方程式为2NH3(g) N2(g)+3H2(g);△H=+Q2KJ/mol
N2(g)+3H2(g);△H=+Q2KJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是一些重要工业生产的转化关系(反应条件略去)。
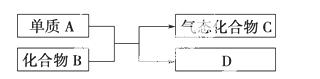
请完成下列问题:
(1)若D是单质,且与A属于同一主族,则:
①反应的化学方程式是_____________________________________________
_______________________________。
②D的原子结构示意图是________。
③D单质的一种重要用途是__________________________________________
_________________________________________。
(2)若B为黄色固体,D为固体化合物,则:
①该反应的化学方程式是____________________________________________
____________________________________。
②生产该工业品的工厂应建在离________较近的地方。
③实验室检验C的方法是____________________________________________
_________________ ______________________。
______________________。
(3)若B是一种有刺激性气味的气体,则 :
:
①B分子的空间构型为________。
②实验室进行此实验时,常看到有大量白烟 产生,产生大量白烟的原因是____________________________________________________________。
产生,产生大量白烟的原因是____________________________________________________________。
③化合物C在一定体积的容器中,在一定条件下发生反应,测得容器内气体的压强略小于原来的。请写出该反应的化学方程式_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
(1)冶炼铜的反应为8CuFeS2+21O2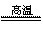 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号)。
(2)上述冶炼过程中产生大量SO2。下列处理方案合理的是 (填代号)。
a.高空排放
b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO3
d.用浓硫酸吸收
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:
S2O82-+2I-=2SO42-+I2
通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应的催化过程。 、 (不必配平)。
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、AI2O3)可制备Fe2O3。方法为
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得。
据以上信息回答下列问题:
a.除去Al3+的离子方程式是 。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为 。证明炉渣中含有的实验现象为
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com