
| A. | 148g•mol-1 | B. | 100g•mol-1 | C. | 90g•mol-1 | D. | 38g•mol-1 |
科目:高中化学 来源: 题型:选择题
| A. | 将铁粉加入FeCl3、CuCl2混合溶液中,充分反应后剩余的固体中必有铁 | |
| B. | 浓硫酸和浓盐酸长期露置在空气中浓度均降低 | |
| C. | 将CO2气体分别通入BaCl2溶液、Ba(NO3)2溶液中,最终都有沉淀生成 | |
| D. | 用加热分解的方法可将NH4Cl固体和Ca(OH)2固体的混合物分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
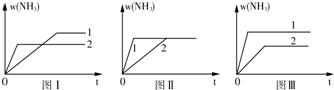
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人类目前所直接利用的能量大部分是由化学反应产生的 | |
| B. | 人体运动所消耗的能量与化学反应无关 | |
| C. | 在多能源时期,氢能、生物质能等的核心仍然是化学反应 | |
| D. | 核能、太阳能的利用取决于新型材料的合成与开发 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
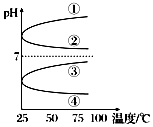 A、B、C、D、E五种物分别是NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:
A、B、C、D、E五种物分别是NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能够发生化学反应的碰撞是有效碰撞 | |
| B. | 增大浓度会加快化学反应速率,其原因是增加了单位体积内活化分子的数目 | |
| C. | 稀溶液中:H+(aq)+OH-(aq)=H2O(l)△H=-53.7kJ•mol-1,若将含0.5 molH2SO4的稀硫酸与含0.5molBa(OH)2的溶液混合,放出的热量大于53.7kJ | |
| D. | 若化学平衡正向移动,则反应物的转化率会增大,平衡常数也必发生变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com