
【题目】葡萄糖酸锌{M[Zn(C6H11O7)2]=455g·mol-1)是一种重要的补锌试剂,其在医药、食品、饲料、化妆品等领城中具有广泛的应用。纯净的葡葡糖酸锌为白色晶体,可溶于水,极易溶于热水,不溶于乙醇,化学兴趣小组欲在实验室制备葡萄糖酸锌并测定产率。实验操作分以下两步:
Ⅰ.葡萄糖酸(C6H12O7)的制备。量取50 mL蒸馏水于100 mL烧杯中,搅拌下缓慢加入2.7 mL(0.05 mol)浓H2SO4,分批加入21.5 g葡萄糖酸钙{M[Ca(C6H11O7)2]=430g·mol-1,易溶于热水},在90℃条件下,不断搅拌,反应40min后,趁热过滤。滤液转移至小烧杯,冷却后,缓慢通过强酸性阳离子交换树脂,交换液收集在烧杯中,得到无色的葡葡糖酸溶液。
Ⅱ.葡萄糖酸锌的制备。向上述制得的葡萄糖酸溶液中分批加入足量的ZnO,在60℃条件下,不断搅拌,反应1h,此时溶液pH≈6。趁热减压过滤,冷却结晶,同时加入10 mL 95%乙醇,经过一系列操作,得到白色晶体,经干燥后称量晶体的质量为18.2g。
回答下列问题:
(1)制备葡萄糖酸的化学方程式为________________。
(2)通过强酸性阳离子交换树脂的目的是_______________。
(3)检验葡萄糖酸溶液中是否存在SO42-的操作为_________。
(4)制备葡萄糖酸时选用的最佳加热方式为_______________。
(5)制备葡萄糖酸锌时加入乙醇的目的是________,“一系列操作”具体是指_______。
(6)葡萄糖酸锌的产率为______(用百分数表示),若pH≈5时就进行后续操作,产率将_____(填“增大”“减小”或“不变”)。
【答案】![]() 将未充分反应的葡萄糖转化为葡萄糖酸 取适量葡萄糖酸试液,向其中加入足量的稀盐酸,无明显现象,再滴加BaCl2溶液,若产生白色沉淀,则证明葡萄糖酸溶液中还存在SO42-,反之则不存在 水浴加热(或热水浴) 降低葡萄糖酸锌溶解度,便于晶体析出 过滤、洗涤 80% 减小
将未充分反应的葡萄糖转化为葡萄糖酸 取适量葡萄糖酸试液,向其中加入足量的稀盐酸,无明显现象,再滴加BaCl2溶液,若产生白色沉淀,则证明葡萄糖酸溶液中还存在SO42-,反之则不存在 水浴加热(或热水浴) 降低葡萄糖酸锌溶解度,便于晶体析出 过滤、洗涤 80% 减小
【解析】
(1)葡萄糖酸钙Ca(C6H11O7)2与硫酸H2SO4反应生成葡萄糖酸(C6H12O7),原理为强酸制弱酸,化学反应方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)将葡萄糖酸钙与硫酸反应后的滤液缓慢通过强酸性阳离子交换树脂进行阳离子交换,可将为充分反应的Ca2+交换为H+,即将未充分反应的葡萄糖酸钙转化为葡萄糖酸,故答案为:将未充分反应的葡萄糖转化为葡萄糖酸;
(3)结合SO42-离子的检验方法,可取适量葡萄糖酸试液,向其中加入足量的稀盐酸,无明显现象,再滴加BaCl2溶液,若产生白色沉淀,则证明葡萄糖酸溶液中还存在SO42-,反之则不存在,故答案为:取适量葡萄糖酸试液,向其中加入足量的稀盐酸,无明显现象,再滴加BaCl2溶液,若产生白色沉淀,则证明葡萄糖酸溶液中还存在SO42-,反之则不存在;
(4)实验Ⅰ制备葡糖糖酸时,反应条件为90℃,则最佳的加热方式为水浴加热(或热水浴),故答案为:水浴加热(或热水浴);
(5)葡萄糖酸锌可溶于水,极易溶于热水,不溶于乙醇,生成葡萄糖酸锌后,加入乙醇可减少葡萄糖酸锌的溶解,使其以晶体的形式析出,加入乙醇后的“一些列操作”可以是过滤、洗涤,故答案为:降低葡萄糖酸锌溶解度,便于晶体析出;过滤、洗涤;
(6)根据反应方程式可得关系式:Ca(C6H11O7)2~ Zn(C6H11O7)2,m[Ca(C6H11O7)2]=21.5g,则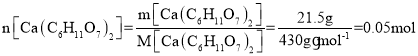 ,则理论上可得到葡萄糖酸锌的物质的量为n[Zn(C6H11O7)2]=0.05mol,因此,
,则理论上可得到葡萄糖酸锌的物质的量为n[Zn(C6H11O7)2]=0.05mol,因此,![]() ,根据
,根据![]() 可得,葡萄糖酸锌的产率为
可得,葡萄糖酸锌的产率为![]() ,若pH≈5时就进行后续操作,一些葡萄糖酸就不能充分转化为葡萄糖酸锌,导致葡萄糖酸锌质量将减小,产率减小,故答案为:80%;减小;
,若pH≈5时就进行后续操作,一些葡萄糖酸就不能充分转化为葡萄糖酸锌,导致葡萄糖酸锌质量将减小,产率减小,故答案为:80%;减小;


科目:高中化学 来源: 题型:
【题目】在氮及其化合物的化工生产中,对有关反应的反应原理进行研究有着重要意义。
(1)t℃时,关于N2、NH3的两个反应的信息如下表所示:
化学反应 | 正反应活化能 | 逆反应活化能 | t℃时平衡常数 |
N2(g)+O2(g)=2NO(g) △H>0 | a kJ/mol | b kJ/mol | K1 |
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H<0 | c kJ/mol | d kJ/mol | K2 |
请写出t℃时氨气被一氧化氮氧化生成无毒气体的热化学方程式:______________________,t℃时该反应的平衡常数为__________ (用K1和K2表示)。
(2)工业合成氨的原理为:N2(g)+3H2(g)![]() 2NH3(g)下图甲表示在一定体积的密闭容器中反应时,H2的物质的量浓度随时间的变化。图乙表示在其他条件不变的情况下,起始投料H2与N2的物质的量之比(设为x)与平衡时NH3的物质的量分数的关系。
2NH3(g)下图甲表示在一定体积的密闭容器中反应时,H2的物质的量浓度随时间的变化。图乙表示在其他条件不变的情况下,起始投料H2与N2的物质的量之比(设为x)与平衡时NH3的物质的量分数的关系。

①图甲中0~t1 min内,v(N2)=_____mol·L-1·min-1;b点的v(H2)正_____a点的v(H2)逆(填“大于”“小于”或“等于”)。
②己知某温度下该反应达平衡时各物质均为1 mol,容器体积为1L,保持温度和压强不变,又充入3 mol N2后,平衡________(填“向右移动”“向左移动”或“不移动”)。
(3)①科学家研究出以尿素为动力的燃料电池新技术。用这种电池可直接去除城市废水中的尿素,既能产生净化的水,又能发电。尿素燃料电池结构如图所示,写出负极电极反应式:________________________________________________。
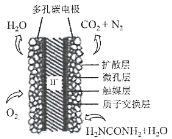
②理论上电池工作时,每消耗标准状况下2.24 L O2时,可产生的电量为________ (法拉第常数为96500C/ mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳九芳烃是一种混合物,异丙苯就是其中的一种。工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如下。下列有关说法正确的是
![]()
A. a的同分异构体有7种B. a能发生取代反应、加成反应和氧化反应
C. b的分子式为![]() D. b、c互为同系物
D. b、c互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象、结论、因果关系均正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 向淀粉溶液中滴加稀硫酸,加热,再加碘水 | 溶液变蓝 | 淀粉没有水解 |
B | 将 |
| 有乙烯生成 |
C | 向 | 产生砖红色沉淀 | 葡萄糖具有还原性 |
D | 将乙醇加入浓硫酸中,快速加热到170℃,将产生的气体通入溴水 | 溴水褪色 | 不能证明有乙烯生成 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常用的食品抗氧化剂BHT的合成方法如下图所示(假设原料均能恰好完全反应):

下列说法中不正确的是( )
A.方法一的原子利用率为100%
B.方法二属于取代反应
C.X与Y均能与![]() 、
、![]() 溶液、溴水发生反应
溶液、溴水发生反应
D.![]() 在稀
在稀![]() 条件下发生消去反应可生成
条件下发生消去反应可生成![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
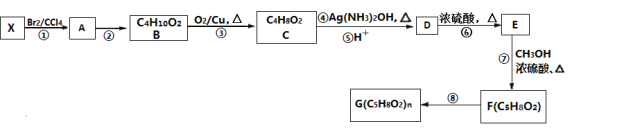
【题目】PMMA是一种具有较好的透明性、化学稳定性、易染色、易加工、外观优美的塑料,在建筑业中有着广泛应用,分子式是![]() 。一种从原料
。一种从原料![]() 合成PMMA的路线如图所示:
合成PMMA的路线如图所示:
请回答:
(1)原料X的结构简式为________。
(2)②的反应类型是________。F中含有的官能团名称是________。
(3)写出④的化学方程式________。
(4)D的同分异构体中,能发生银镜反应、水解反应和酯化反应的同分异构体有________种。
(5)已知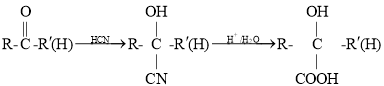 (其中R、
(其中R、![]() 均代表烃基)。若以丙烯为原料,利用上述信息设计合成中间体D,在得到D的同时也得到了另一种有机副产物M,则M可能的结构简式是________。
均代表烃基)。若以丙烯为原料,利用上述信息设计合成中间体D,在得到D的同时也得到了另一种有机副产物M,则M可能的结构简式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
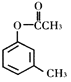
【题目】一定条件下,有机化合物Y可发生重排反应:
 (X)
(X)![]()
 (Y)
(Y)![]()
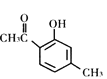 (Z)
(Z)
下列说法不正确的是
A.X、Y、Z互为同分异构体
B.1mol X最多能与3molH2发生加成反应
C.1mol Y最多能与2molNaOH发生反应
D.通过调控温度可以得到不同的目标产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院科学家设计出一套利用SO2和太阳能综合制氢方案,其基本工作原理如图所示。下列说法错误的是
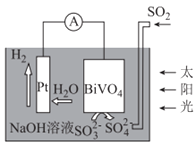
A.该电化学装置中,Pt电极作正极
B.Pt电极的电势高于BiVO4电极的电势
C.电子流向:Pt电极→导线→BiVO4电极→电解质溶液→Pt电极
D.BiVO4电极上的反应式为SO32--2e-+2OH-=SO42-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种重要的降血糖药物M(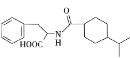 )的合成路线如下(略去部分反应条件):
)的合成路线如下(略去部分反应条件):
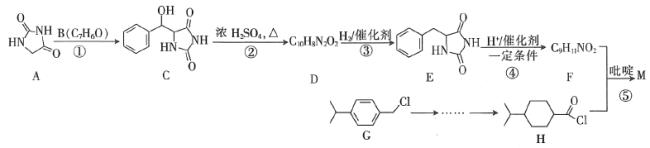
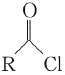
已知: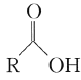
![]()
回答下列问题:
(1)B的名称为________,F的结构简式为________。
(2)反应②的反应类型为________。
(3)下列关于上述涉及的有机物的说法正确的是________(填标号)。
a.化合物E能使酸性高锰酸钾溶液褪色
b.化合物F既能与盐酸反应,又能与![]() 溶液反应
溶液反应
c.M中含氧官能团的名称为酯基、酮基
(4)写出![]() 的化学方程式:________。
的化学方程式:________。
(5)由G可制得物质I(![]() ),写出满足下列条件的I的同分异构体的结构简式:________。
),写出满足下列条件的I的同分异构体的结构简式:________。
①能与![]() 溶液发生显色反应
溶液发生显色反应
②除苯环外不含其他环
③![]() 谱中峰面积之比为
谱中峰面积之比为![]()
(6)请设计以G为原料合成H的合理路线流程图(无机试剂任选)。_______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com