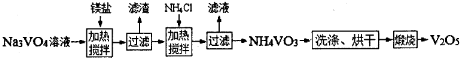
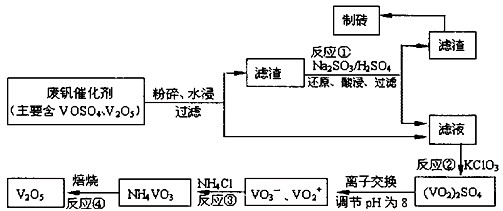
随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”.已知钒的原子序数为23,相对原子质量为51,试回答下列问题:
(1)钒在元素周期表位于第 周期,第 族.
(2)钒被认为是一种稀土元素,广泛分散于各种矿物中,钾钒铀矿中的化学式为K2H6U2V2O15(其中钒元素的化合价为+5价).若用氧化物的形式表示,该化合物的化学式为 .
(3)测定钒含量的方法是先把钒转化成V2O5,V2O5在酸性溶液里转变成VO2+,再用盐酸、硫酸亚铁、草酸等测定钒.请配平下列反应的化学方程式: VO2++ H2C2O4→ VO++ CO2+ H2O其中还原剂是 ;若反应消耗0.90g草酸,参加反应的钒元素质量是 g.
(4)工业上由V2O5冶炼金属钒常用铝热剂法.试用化学方程式表示出来 .
【答案】
分析:(1)钒核外电子排布式为1s
22s
22p
63s
23p
63d
34s
2,据此确定在周期表中位置.
(2)根据各元素化合价写出相应的氧化物,氧化物之间以“?”隔开,系数配置出现的分数应化为整数,各元素原子数目比不能变化.
(3)VO
2+中V元素化合价由+5价降低为VO
+中+3价,H
2C
2O
4中碳元素由+3价升高为CO
2中+4价,H
2C
2O
4是还原剂;化合价升降的最小公倍数为2,所以VO
2+系数为1,H
2C
2O
4系数为1,再根据原子守恒(电荷守恒)配平其它物质的系数.
0.90g草酸的物质的量为0.01mol,根据离子方程式计算参加反应的n(VO
2+),据此计算参加反应的钒元素质量.
(4)铝热反应实质是置换反应,铝与五氧化二钒反应生成钒与氧化铝.
解答:解:(1)钒核外电子排布式为1s
22s
22p
63s
23p
63d
34s
2,处于d区,故钒处于第四周期第ⅤB族.
故答案为:四;ⅤB.
(2)钾钒铀矿中的化学式为K
2H
6U
2V
2O
15,用氧化物的形式表示,根据各元素化合价写出相应的氧化物,氧化物之间以“?”隔开,系数配置出现的分数应化为整数,各元素原子数目比不能变化,该化合物的化学式为K
2O?V
2O
5?2UO
3?3H
2O.
故答案为:K
2O?V
2O
5?2UO
3?3H
2O.
(3)VO
2+中V元素化合价由+5价降低为VO
+中+3价,H
2C
2O
4中碳元素由+3价升高为CO
2中+4价,H
2C
2O
4是还原剂;化合价升降的最小公倍数为2,所以VO
2+系数为1,H
2C
2O
4系数为1,根据原子守恒可知,VO
+,系数为1,CO
2系数为2,H
2O系数为1.配平后离子方程式为VO
2++H
2C
2O
4═VO
++2CO
2+H
2O.0.90g草酸的物质的量为
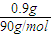
=0.01mol,由方程式可知n(VO
2+)=0.01mol,所以参加反应的钒元素的质量为0.01mol×51g/mol=0.51g.
故答案为:1、1、1、2、1;还原剂;0.51.
(4)铝与五氧化二钒反应生成钒与氧化铝,反应反应方程式为3V
2O
5+10Al

6V+5Al
2O
3.
故答案为:3V
2O
5+10Al

6V+5Al
2O
3.
点评:考查氧化还原反应配平、计算等,难度不大,掌握根据电子转移配平方程式.

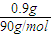 =0.01mol,由方程式可知n(VO2+)=0.01mol,所以参加反应的钒元素的质量为0.01mol×51g/mol=0.51g.
=0.01mol,由方程式可知n(VO2+)=0.01mol,所以参加反应的钒元素的质量为0.01mol×51g/mol=0.51g. 6V+5Al2O3.
6V+5Al2O3. 6V+5Al2O3.
6V+5Al2O3.

 阅读快车系列答案
阅读快车系列答案
 其中a、c二步的化学方程式可表示为
其中a、c二步的化学方程式可表示为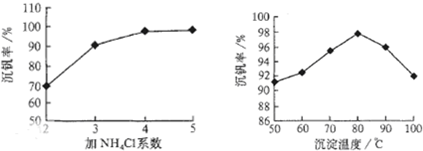
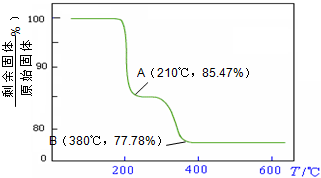 则NH4VO3在分解过程中
则NH4VO3在分解过程中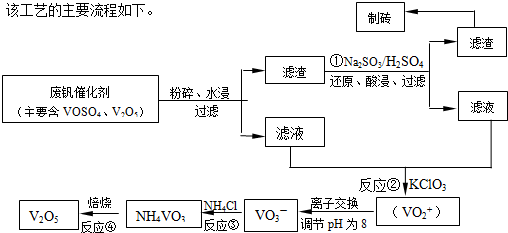
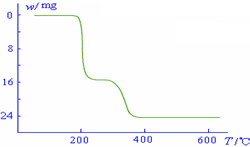 化的曲线如右图所示.则NH4VO3在分解过程中
化的曲线如右图所示.则NH4VO3在分解过程中