
物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是( )
A. 1:4 B. 1:5 C. 2:3 D. 2:5
考点: 硝酸的化学性质;氧化还原反应的电子转移数目计算.
专题: 氧化还原反应专题;氮族元素.
分析: 锌与稀硝酸反应时硝酸既表现酸性又表现氧化性,根据原子守恒和电子守恒规律来解决.
解答: 解:锌与稀硝酸反应时硝酸既表现酸性又表现氧化性,根据原子守恒和电子守恒,2mol锌失去4mol电子,生成2mol锌离子,由于生成硝酸锌,则其结合的硝酸根离子是4mol,则剩余的1mol的硝酸被还原为N2O就得到4mol电子,硝酸也全部反应,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是1:4,即4Zn+10HNO3(一般稀)=4Zn(NO3)2+N2O↑+5H2O.故选A.
点评: 本题是对硝酸的氧化性知识的考查,注意电子守恒思想在氧化还原反应中的运用.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
有机物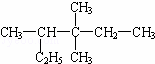 的正确命名是( )
的正确命名是( )
|
| A. | 3,3﹣二甲基﹣4﹣乙基戊烷 | B. | 3,3,4﹣三甲基己烷 |
|
| C. | 3,4,4﹣三甲基己烷 | D. | 2,3,3﹣三甲基己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
请按要求填空
(1)下列实验操作或对实验事实的描述不正确的是 (填序号)
①用热的浓HCl洗涤附着有MnO2的试管;
②浓硫酸不小心沾在皮肤上,先用抹布擦干净,再用大量的水冲洗;
③测定硫酸铜晶体中结晶水含量的实验中,至少需经过4次称量;④蒸馏石油时,冷凝管中的冷水应上进下出;
⑤向蛋白质溶液中加入浓的无机盐(如Na2SO4、CuSO4)溶液,可使蛋白质盐析而分离提纯;
⑥配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用滴管吸去多余的部分.
(2)实验室利用如图装置进行中和热的测定.
回答下列问题:
①该图中有两处未画出,它们是 、 ;
②在操作正确的前提下提高中和热测定的准确性的关键是 ;
③如果用0.5 mol/L的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中和热”将 (填“偏大”、“偏小”、“不变”);原因是 .
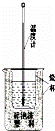
查看答案和解析>>
科目:高中化学 来源: 题型:
把100mL含有MgSO4和K2SO4的混合溶液分成二等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡.则原混合溶液中钾离子的浓度为( )
A. 20(2b﹣a) mol/L B. 20(b﹣2a) mol/L C. 10(2b﹣a) mol/L D. 10(b﹣2a) mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质应用的说法错误的是( )
A. 玻璃容器可长期盛放各种酸
B. 纯碱可用于清洗油污
C. 浓氨水可检验氯气管道泄漏
D. 水玻璃是制备硅胶和木材防火剂的原料
查看答案和解析>>
科目:高中化学 来源: 题型:
卤族元素及其化合物与社会、生活关系密切.下列有关说法错误的是( )
A. 加碘食盐中加入的是KIO3
B. 常用于杀菌消毒的84消毒液的主要成份是NaClO
C. CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
D. 变色眼镜和照相器材的生产都可能要用到溴化银
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是( )
选项 叙述Ⅰ 叙述Ⅱ
A NH4Cl为强酸弱碱盐 用加热法除去NaCl中的NH4Cl
B Fe3+具有氧化性 用KSCN溶液可以鉴别Fe3+
C 溶解度:CaCO3<Ca(HCO3)2 溶解度:Na2CO3<NaHCO3
D SiO2可与HF反应 氢氟酸不能保存在玻璃瓶中
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,属于氧化反应的是( )
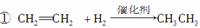
②2CH3CHO+O2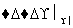 2CH3COOH
2CH3COOH
③CH3CHO+2Cu(OH)2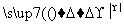 CH3COOH+Cu2O↓+2H2O
CH3COOH+Cu2O↓+2H2O
④CH3CHO+H2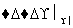 CH3CH2OH
CH3CH2OH
A.①② B.②③
C.③④ D.①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com