
已知反应A+B=C+D的能量变化如图所示,下列说法正确的是( )

A.该反应为吸热反应
B.该反应为放热反应
C.反应物的总能量高于生成物的总能量
D.该反应只有在加热条件下才能进行
 综合自测系列答案
综合自测系列答案科目:高中化学 来源:2015-2016学年江苏省宝应县高一下学期期中调研联合考试化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.金刚石和石墨互为同素异形体
B.CH3-CH2OH和 CH3-O-CH3 互为同分异构体
C.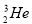 和
和 互为同位素
互为同位素
D.分子式为C4H10的物质为纯净物
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二下学期第一次月考化学试卷(解析版) 题型:选择题
某同学查阅资料时获得对一原子中某电子运动状态的描述,判断其中描述一定错误的是( )
A.能层n=3 能级种类d 自旋状态↑ B.能层n=2 能级种类d 自旋状态↓
C.能层n=4 能级种类p 自旋状态↓ D.能层n=3 能级种类p 自旋状态↑
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省临沂市高一下学期期中考试化学试卷(解析版) 题型:选择题
下列有关放热反应、吸热反应的说法不正确的是( )
A.吸热反应的发生都需要加热,放热反应在常温下一定容易发生
B.若某反应正向进行时为放热反应,则该反应逆向进行时必为吸热反应
C.由“C(石墨)= C(金刚石)是吸热反应 ”可知石墨比金刚石稳定
D.不管是吸热反应还是放热反应,升高温度,反应速率均增大
查看答案和解析>>
科目:高中化学 来源:2016届青海省高三下高考冲刺一理综化学试卷(解析版) 题型:实验题
阿司匹林口服时,具有解热镇痛作用。是一种常用的治疗感冒的药物,也可用于抗风湿,促进痛风患者尿酸的排泄。近年来还发现阿司匹林能抑制血小板凝聚,可防止血栓的生成。它的有效成分是乙酰水杨酸( )。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐【(CH3CO)2O】为主要原料合成乙酰水杨酸。
)。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐【(CH3CO)2O】为主要原料合成乙酰水杨酸。
【反应原理及部分装置】
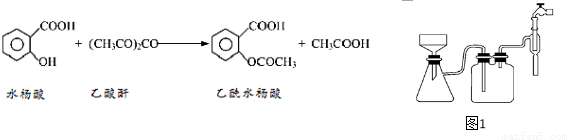
【实验流程】
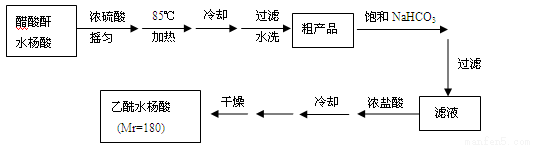
已知:①醋酸酐遇水分解生成醋酸。
②水杨酸和乙酰水杨酸均微溶于水,但其钠盐易溶于水,副产物为高分子化合物,难溶于水。
回答下列问题:
(1)合成过程中要控制温度在85℃~90℃,最合适的加热方法 。
(2)用图1装置过滤比普通漏斗过滤的优点是 。
(3)粗产品提纯:
①分批用少量饱和NaHCO3溶液溶解粗产品,目的是 ;判断该过程结束的现象是 。
②加浓盐酸、冷却后的操作是__________、______、干燥、称重、计算产率。
③纯度检验:取少许产品加入盛有2 mL水的试管中,加入1~2滴FeCl3溶液,溶液呈浅紫色。可能的原因是 。
(4)阿司匹林药片中乙酰水杨酸含量的测定步骤(假定只含乙酰水杨酸和辅料,辅料不参与反应):
Ⅰ.称取阿司匹林样品mg;
Ⅱ.将样品研碎,溶于V1 mL a mol/LNaOH(过量)并加热,除去辅料等不溶物,将所得溶液移入锥形瓶;
Ⅲ.向锥形瓶中滴加几滴甲基橙,用浓度为b mol/L的标准盐酸滴定剩余的NaOH,消耗盐酸的体积为V2 mL。
已知:乙酰水杨酸与过量NaOH溶液加热发生反应的化学方程式:
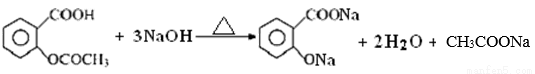
则阿司匹林药片中乙酰水杨酸质量分数的表达式为:____________________。
查看答案和解析>>
科目:高中化学 来源:2016届青海省高三下高考冲刺一理综化学试卷(解析版) 题型:选择题
室温下用下列实验装置进行相应实验,能达到实验目的的是

A.图1:验证浓硫酸具有强氧化性 B.图2:制取干燥的NH3
C.图3:干燥、收集并吸收多余SO2 D.图4:验证乙炔的还原性
查看答案和解析>>
科目:高中化学 来源:2016届宁夏银川一中高三三模理综化学试卷(解析版) 题型:填空题
稀土元素是指元素周期表中原子序数为57到71的15种镧系元素,以及与镧系元素化学性质相似的钪(Sc)和钇(Y)共17种元素。回答下列问题:
(1)钪(Sc)元素的原子核外电子排布式为______________________。镝(Dy)的基态原子电子排布式为[Xe]4f106s2,一个基态镝原子所含的未成对电子数为________。
(2)稀土元素最常见的化合价为+3价,但也有少数还有+4价。请根据下表中的电离能数据判断表中最有可能有+4价的元素是________。几种稀土元素的电离能(单位:kJ·mol-1)
元素 | I1 | I2 | I3 | I4 |
Sc(钪) | 633 | 1 235 | 2 389 | 7 019 |
Y(钇) | 616 | 1 181 | 1 980 | 5 963 |
La(镧) | 538 | 1 067 | 1 850 | 4 819 |
Ce(铈) | 527 | 1 047 | 1 949 | 3 547 |
(3)离子化合物Na3[Sc(OH)6]中,存在的作用力除离子键外还有____________。
(4)Sm(钐)的单质与1,2-二碘乙烷可发生如下反应:
Sm+ICH2CH2I SmI2+CH2=CH2。ICH2CH2I中碳原子杂化类型为______________,1 mol CH2=CH2中含有的σ键数目为________。
SmI2+CH2=CH2。ICH2CH2I中碳原子杂化类型为______________,1 mol CH2=CH2中含有的σ键数目为________。
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中镨原子位于面心和顶点。则PrO2(二氧化镨)的晶胞中有________个氧原子。
(6)Ce(铈)单质为面心立方晶体,晶胞参数为a=516 pm,晶胞中Ce(铈)的配位数为________,列式表示Ce(铈)单质的密度:_______g·cm-3(不必计算出结果)。
查看答案和解析>>
科目:高中化学 来源:2016届湖北省沙市、沙市五中高考模拟理综化学试卷(解析版) 题型:简答题
氮、磷及其化合物在生产、生活中有重要的用途。回答下列问题:
I (1)直链聚磷酸是由n个磷酸分子通过分子间脱水形成的,常用于制取阻燃剂聚磷酸铵。
①写出磷酸主要的电离方程式________________________。
②直链低聚磷酸铵的化学式可表示为(NH4)(n+2)PnOx,x=_____(用n表示)。
(2)在碱性条件下,次磷酸盐可用于化学镀银,完成其反应的离子方程式。
□H2PO2-+□Ag++□______=□PO43-+□Ag+□______
(3) 工业上生产硝酸铜晶体的流程图如下:
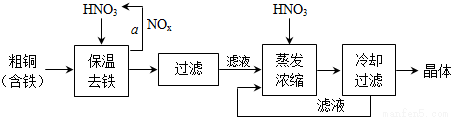
①在步骤a中,需要通入氧气和水,其目的是______.
②进行蒸发浓缩时,要用硝酸调节溶液的pH=1,其目的是(结合离子方程式说明)______.
③下图是某小组同学查阅资料所绘出的硝酸铜晶体[Cu(NO3)2•nH2O]的溶解度曲线(温度在30℃前后对应不同的晶体),下列说法正确的是______(填字母).
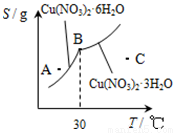
a.A点时的溶液为不饱和溶液
b.B点时两种晶体可以共存
c.按上述流程最终得到的晶体是Cu(NO3)2•3H2O
d.若将C点时的溶液降温至30℃以下,可以析出Cu(NO3)2•6H2O晶体
II (4)查阅资料可知:银氨溶液中存在平衡:Ag+(aq)+2NH3(aq) Ag(NH3)2+(aq),该反应平衡常数的表达式K稳[Ag(NH3)2+]= _________,已知某温度下,K稳[Ag(NH3)2+]=1.10×107,Ksp[AgCl]=1.45×10﹣10。计算得到可逆反应AgCl(s)+2NH3(aq)
Ag(NH3)2+(aq),该反应平衡常数的表达式K稳[Ag(NH3)2+]= _________,已知某温度下,K稳[Ag(NH3)2+]=1.10×107,Ksp[AgCl]=1.45×10﹣10。计算得到可逆反应AgCl(s)+2NH3(aq) Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=_________ (保留2位有效数字),1L 1mol/L氨水中最多可以溶解AgCl_________mol(保留1位有效数字)。
Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=_________ (保留2位有效数字),1L 1mol/L氨水中最多可以溶解AgCl_________mol(保留1位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com