
| A. | 用食醋除去暖水瓶中的薄层水垢 | |
| B. | 用米汤检验食盐中是否含碘酸钾(KIO3) | |
| C. | 医用酒精的浓度通常为75%,可用于杀菌消毒 | |
| D. | 用灼烧并闻气味的方法区别纯棉织物和纯羊毛织物 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | CO${\;}_{3}^{2-}$ | B. | HCO${\;}_{3}^{-}$ | C. | CH3COO- | D. | SO${\;}_{3}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 茶氨酸由C、H、O、N四种元素组成 | |
| B. | 每个茶氨酸分子含有26个原子 | |
| C. | 茶氨酸中碳元素与氢元素的质量比为6:1 | |
| D. | 每个茶氨酸分子中含有1个N2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{10}{11}$ | B. | $\frac{7}{11}$ | C. | $\frac{6}{11}$ | D. | $\frac{4}{11}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 实验室制取乙烯气体时,将温度计的水银球放入液面以下 | |
| B. | 向淀粉水解后的溶液中加入碘水,溶液变蓝,证明淀粉尚未水解 | |
| C. | 证明分子CH2=CH-CHO既含有醛基又含有C=C,可先向溶液中先加入足量的银氨溶液加热,充分反应后,再加入足量的溴水 | |
| D. | 在蔗糖与稀硫酸共热后的溶液中,滴加银氨溶液,验证产物中的葡萄糖 | |
| E. | 用新制的银氨溶液可区分甲酸甲酯和乙醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a | B. | b | C. | c | D. | d |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知①A是一种分子量为28的气态烃,②2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH,现以A为主要原料合成一种具有果香味的物质E,其合成路线如图所示.请回答下列问题:
已知①A是一种分子量为28的气态烃,②2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH,现以A为主要原料合成一种具有果香味的物质E,其合成路线如图所示.请回答下列问题: ,B分子中的官能团名称羟基.
,B分子中的官能团名称羟基. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
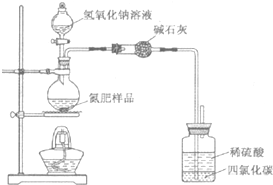 某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:
某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:| 氢氧化钠溶液/mL | 40.00 | ||
| 样品质量/g | 7.750 | 15.50 | 23.25 |
| 氨气质量/g | 1.870 | 1.870 | 1.700 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com