
【题目】铁和铜都是日常生活中常见的金属,有着广泛的用途。请回答下列问题:
(1)铁在元素周期表中的位置_________。
(2)配合物Fe(CO)n常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)n晶体属于______(填晶体类型)。Fe(CO)n的中心原子价电子数与配体提供电子数之和为18,则n=______ 。Fe(CO)n在一定条件下发生反应:Fe(CO)n(s)![]() Fe(s)+ n CO(g)。已知反应过程中只断裂配位键,则该反应生成物中新形成的化学键类型为___________。
Fe(s)+ n CO(g)。已知反应过程中只断裂配位键,则该反应生成物中新形成的化学键类型为___________。
(3)K3[Fe(CN)6]溶液可用于检验________(填离子符号)。CN-中碳原子杂化轨道类型为_________,C、N、O三元素的第一电离能由大到小的顺序为_______(用元素符号表示)。
(4)铜晶体的晶胞如右图所示。

①基态铜原子的核外电子排布式为________________。
②每个铜原子周围距离最近的铜原子数目________。
(5)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如附图所示(黑点代表铜原子)。
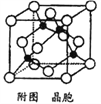
①该晶体的化学式为____________。
②已知该晶体的密度为g.cm-3,阿伏伽德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为_________pm(只写计算式)。
【答案】 第四周期第Ⅷ族 分子晶体 5 金属键 Fe2+ sp杂化 N>O>C [Ar]3d104s1 或1s22s22p63s23p63d104s1 12 CuCl 
【解析】(1)本题考查元素在周期表的位置,铁位于第四周期VIII族;(2)考查晶体类型的判断、化学键类型,Fe(CO)n常温下呈液态,熔点、沸点较低,易溶于非极性溶剂,这是分子晶体的特点,因此Fe(CO)n属于分子晶体,中心原子为Fe,铁位于VIII族,价电子包括最外层和次外层的d能级,因此价电子数为8,CO有C提供2个孤电子对与铁构成配位键,因此有8+2n=18,即n=5,根据反应方程式,断裂的是配位键,生成物生成了Fe单质,即生成了金属键;(3)本题考查配位化合物、杂化类型、第一电离能规律,K3[Fe(CN)6]检验Fe2+,滴入K3[Fe(CN)6]溶液,出现蓝色沉淀,说明Fe2+的存在,CN-中碳原子与N形成1个σ键,孤电子对数为(4+1-3)/2=1,价层电子对数为2,杂化轨道数等于价层电子对数,即杂化类型为sp,同周期从左向右第一电离能增大,但IIA>IIA、VA>VIA,因此C、N、O的第一电离能的顺序是N>O>C;(4)考查电子排布式的书写和晶胞,铜位于第四周期IB族,因此核外电子排布式是[Ar]3d104s1 或1s22s22p63s23p63d104s1,距离最近的铜原子在面上,每个铜原子周围距离最近的铜原子数目为12(上层4个、同层4个、下层4个);(5)本题考查晶胞的结构,①根据M的外围电子排布式,推出M为Cl,白球位于顶点和面心,因此白球的个数为8×1/8+6×1/2=4,黑球位于体心,有4个,因此化学式为CuCl;②铜原子和Cl原子最近的距离是体对角线的1/4,令晶胞的边长为apm,晶胞的质量为 ,晶胞的体积为(a×10-10)3cm3,根据密度的定义推出a=
,晶胞的体积为(a×10-10)3cm3,根据密度的定义推出a=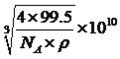 ,即最近的距离为
,即最近的距离为![]() 。
。


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增加。K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体。K 是无色气体,是主要的大气污染物之一。0.05 mol/L丙溶液的pH为1,上述物质的转化关系如图所示。下列说法正确的是

A. K、L、M 中沸点最高的是M
B. 元素的非金属性:Z>Y>X
C. 原子半径:W<X<Y
D. 丙也可由W、Y组成的某化合物与K直接反应制得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体d,呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别是( )
a(干燥气体) | b(液体) |
| |
A | NO | 水 | |
B | CO2 | 4molL﹣1NaOH溶液 | |
C | Cl2 | 饱和NaCl溶液 | |
D | NH3 | 热的浓的NaOH溶液 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列物质:①Fe ②CO2 ③H2SO4 ④Ba(OH)2溶液 ⑤NaCl 其中属于酸的是___(填序号,下同),属于碱的是___,属于盐的是____,属于氧化物的是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0L恒容密闭容器中充入1.0 molPCl5,反应PCl5(g)![]() PCl3(g)+Cl2(g) 经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g) 经一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是
A. 反应在前50 s的平均速率为v (PCl3)=0.0032 mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11 mol·L-1,则反应的△H<0
C. 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,达到平衡前v (正)>v (逆)
D. 相同温度下,起始时向容器中充入2.0 mol PCl3、2.0 mol Cl2,达到平衡时,PCl3的转化率小于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 从溴水中提取溴可通过加入乙醇萃取
B. 蒸馏时为了提高冷凝效果,从冷凝管的上口通入冷水效果更好
C. 分液时,分液漏斗中下层液体流净后及时关闭活塞,再把上层液体从上口倒出
D. 所有蒸馏操作中都必须用到温度计
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2017江苏]化合物H是一种用于合成γ-分泌调节剂的药物中间体,其合成路线流程图如下:
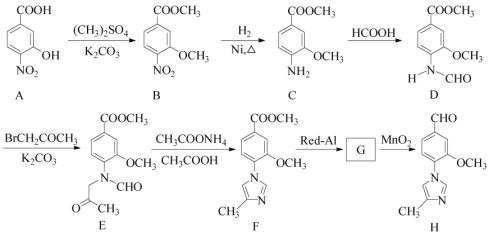
(1)C中的含氧官能团名称为_______和__________。
(2)D→E的反应类型为__________________________。
(3)写出同时满足下列条件的C的一种同分异构体的结构简式:_____________________。
①含有苯环,且分子中有一个手性碳原子;②能发生水解反应,水解产物之一是α-氨基酸,另一水解产物分子中只有2种不同化学环境的氢。
(4)G 的分子式为C12H14N2O2,经氧化得到H,写出G的结构简式:__________________。
(5)已知: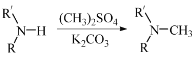 (R代表烃基,R'代表烃基或H)
(R代表烃基,R'代表烃基或H)
请写出以![]() 、
、![]() 和(CH3)2SO4为原料制备
和(CH3)2SO4为原料制备![]() 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com