
| A. | Z+1 | B. | Z+11 | C. | Z+25 | D. | Z+32 |
科目:高中化学 来源: 题型:选择题
| A. | CsCl、SiO2、CBr4、CF4 | B. | SiO2、CsCl、CF4、CBr4 | ||
| C. | SiO2、CsCl、CBr4、CF4 | D. | CF4、CBr4、CsCl、SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
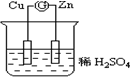 如图所示的原电池装置中,锌为负极,电极发生的是氧化反应(填氧化或还原),电极反应式为Zn-2e-=Zn2+;铜电极反应式为2H++2e-=H2↑,铜片上观察到的现象为有气泡产生.
如图所示的原电池装置中,锌为负极,电极发生的是氧化反应(填氧化或还原),电极反应式为Zn-2e-=Zn2+;铜电极反应式为2H++2e-=H2↑,铜片上观察到的现象为有气泡产生.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油的分馏 | B. | 煤的干馏 | ||
| C. | 氧气变臭氧 | D. | 乙烯通入溴水,溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该晶体为原子晶体 | B. | 该物质的熔沸点较低 | ||
| C. | 该物质是新化合物 | D. | 该物质的相对分子量质量为2400 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol H2SO4的质量是98g•mol-1 | |
| B. | CO2的摩尔质量等于CO2的相对分子质量 | |
| C. | 0.012kg C-12里所含碳原子个数约为6.02×1023个 | |
| D. | 1mol任何物质的质量等于该物质的相对分子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com