
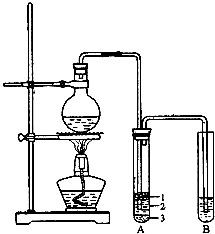
 实验室制取少量溴乙烷的装置如图所示(已知溴乙烷的沸点为38.4℃).根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示(已知溴乙烷的沸点为38.4℃).根据题意完成下列填空:| 加热 |
| 加热 |


 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
| A、利用太阳能制氢 |
| B、推广使用煤液化技术 |
| C、举行“地球一小时”熄灯活动 |
| D、关停小火电企业 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,15 g甲基(-CH3)所含的电子数为7NA |
| B、水的摩尔质量就是NA个水分子的质量之和 |
| C、含NA个Na+的Na2O2溶于1L水中,Na+的物质的量浓度为1mol/L |
| D、1 mo1Mg与足量O2或N2反应生成MgO或Mg3 N2均失去2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | KW | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com