
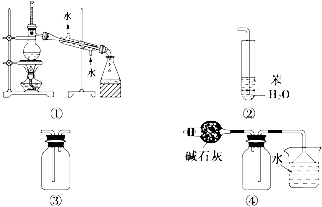
| A、装置①常用于分离乙醇或苯等与水组成的混合物 |
| B、装置②可用于吸收NH3或HCl气体,并防止倒吸 |
| C、装置③可用于收集H2、CO2、Cl2、NO等气体 |
| D、装置④可用于干燥、收集氨气,并吸收多余的氨气 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、46 | B、23 |
| C、11.5 | D、5.75 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化铝的熔点很高,因此可用做耐火材料 |
| B、氯气具有强氧化性,因此可用于漂白棉、麻、纸张 |
| C、氨很容易液化,因此可用作制冷剂 |
| D、某些金属或它们的化合物灼烧时有特殊的颜色,因此可用于制造烟花 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH溶液和AlCl3溶液 |
| B、FeBr2溶液和氯水 |
| C、NaHCO3溶液和澄清石灰水 |
| D、Ca(HCO3)2溶液和澄清石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子积是1.0×10-15 |
| B、温度改变,其离子积不变 |
| C、在液氨中加入NaNH2晶体,则c(NH4+)将减少,离子积不变 |
| D、在液氨中加入NH4Cl晶体,则c(NH4+)将增大,离子积增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学键 | C-H | C-F | H-F | F-F |
| 键能 | 414 | 489 | 565 | 158 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com