
| A、向NaClO溶液中通入少量CO2的离子方程式:ClO-+CO2+H2O=HClO+HCO3- |
| B、碳酸钙溶于稀醋酸:CO32-+2H+=H2O+CO2↑ |
| C、铜与稀硝酸反应:3Cu+2NO3-+8H +=3Cu2++2NO↑+4H2O |
| D、一小块钠投入到CuSO4溶液中:2Na+Cu2+=Cu+2Na+ |


科目:高中化学 来源: 题型:
| A、a=b | B、a>b |
| C、a+b=14 | D、a<14-b |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用氢氟酸雕刻玻璃 |
| B、用浓硝酸雕刻水晶 |
| C、用三氯化铁溶液雕刻铜板 |
| D、用盐酸雕刻汉白玉 |
查看答案和解析>>
科目:高中化学 来源: 题型:
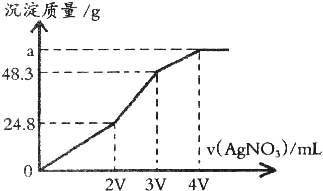
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、SO42-、Cu2+、NO3- |
| B、Fe3+、Na+、I-、HCO3- |
| C、Mg2+、H+、SiO32-、SO42- |
| D、K+、NH4+、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,71gCl2和73gHCl中所含氯原子都是2NA |
| B、在非标准状况下,1mol任何气体的体积不可能是22.4L |
| C、标准状况下,22.4LH2和O2的混合气体中含分子总数为2NA |
| D、10℃时,1molO2的体积一定大于22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化钡溶液与硫酸的反应 OH-+H+=H2O |
| B、金属镁与稀盐酸反应 Mg+2H++2 Cl-=MgCl2+H2↑ |
| C、金属钠投入到冷水中 Na+H2O=Na++OH-+H2↑ |
| D、氯气通入氢氧化钠溶液中 Cl2+2OH-=Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用氢氟酸来刻蚀玻璃器皿 |
| B、用活性炭去除冰箱中的异味 |
| C、用煤液化和气化得到清洁燃料 |
| D、用热碱溶液清除炊具上残留的油污 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com