
| 实验方案 | 实验操作 | 实验现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 | 出现白色沉淀 | |
| ③静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |


科目:高中化学 来源: 题型:阅读理解


查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 碘是人体必须的元素之一,海洋植物如海带、海藻中含有丰富的以碘离子形式存在的碘元素.海带中含有丰富的碘.为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
碘是人体必须的元素之一,海洋植物如海带、海藻中含有丰富的以碘离子形式存在的碘元素.海带中含有丰富的碘.为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
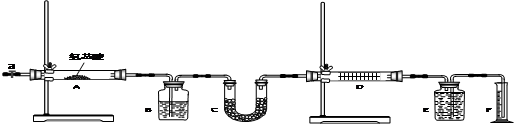
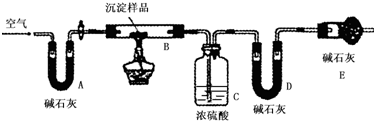
| B装置的质量(g) | C装置的质量(g) | D装置的质量(g) | |
| 实验前 | 15.4 | 262.1 | 223.8 |
| 试验后 | 6.1 | 264.8 | 230.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com