
【题目】(1)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢气的热化学方程式分别为______________________________、__________________________________,制得等量H2所需能量较少的是系统______。(填Ⅰ或Ⅱ)
(2)H2S与CO2在高温下发生反应:H2S(g)+CO2(g) ![]() COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入容积为2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.04。
COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入容积为2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.04。
①H2S的平衡转化率α=_______%,反应平衡常数K=________。(用分数表示)
②在620 K重复上述试验,平衡后水的物质的量分数为0.05,H2S的转化率α2______α1,该反应的△H_____0。(填“>”“<”或“=”)
③向上述反应器中再分别充入下列气体,能使H2S转化率增大的是________。(填标号)
A. H2S B. CO2 C.COS D.N2
【答案】H2O(l)=H2(g)+1/2O2(g) ΔH=+286 kJ/mol H2S(g)=H2(g)+S(s) ΔH=+20 kJ/mol II 5 1/76 > > B
【解析】
利用盖斯定律、“三段式”法计算解答。
(1)虚框内是水分解制氢(I),据盖斯定律将三个热化学方程式直接相加,得H2O(l)=H2(g)+![]() O2(g) ΔH=+286 kJ/mol。实框内是硫化氢分解制氢(II),三个热化学方程式直接相加,得H2S(g)=H2(g)+S(s) ΔH=+20 kJ/mol。制得等量H2时,系统(II)所需能量较少。
O2(g) ΔH=+286 kJ/mol。实框内是硫化氢分解制氢(II),三个热化学方程式直接相加,得H2S(g)=H2(g)+S(s) ΔH=+20 kJ/mol。制得等量H2时,系统(II)所需能量较少。
(2)610 K、2.5 L: CO2(g) + H2S(g) ![]() COS(g) + H2O(g)
COS(g) + H2O(g)
起始/mol: 0.10 0.40 0 0
转化/mol: x x x x
平衡/mol:0.10-x 0.40-x x x
据平衡时水的物质的量分数0.04,求得x=0.02。
①H2S的平衡转化率α1=![]() ×100%=5% ,反应的平衡常数K=
×100%=5% ,反应的平衡常数K=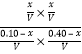 =
=![]() (用分数表示)。
(用分数表示)。
②相当于温度升高到620 K时,平衡移动后水的物质的量分数增大到0.05,即升温使平衡右移,故H2S的转化率α2 > α1,该反应的△H > 0。
③A. 再充H2S,平衡右移,但自身转化率减小;B. 再充CO2 ,平衡右移,H2S转化率增大;C.再充COS,平衡左移,H2S转化率减小;D.再充N2,平衡不移动,H2S转化率不变,能使H2S转化率增大的只有B。


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】使用容量瓶配制溶液时,由于操作不当,会引起误差。下列情况会使所配溶液浓度偏低的是( )
①用天平(使用游码)称量时,被称量物与砝码的位置放颠倒
②溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
③转移溶液前容量瓶内有少量蒸馏水
④定容时,俯视容量瓶的刻度线
⑤定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
A. ①②⑤B. ①③⑤C. ③④⑤D. ②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种物质均易溶于水,分别按下列条件配成溶液,其中物质的量浓度最大的是
A. 0.1 moL D物质溶于100 mL 2.5 mol·L-1的D溶液中
B. 9.2 g B物质(式量为46)溶于水配成100 mL溶液
C. 1.806×1023个C的分子溶于水配成100 mL溶液
D. 10 mL 5mol·L-1的A溶液加水配制成100 mL溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TMB由碳氢氮三种元素组成,其相对分子质量为240,是一种新型指纹检测的色原试剂,已在逐步取代强致癌物联苯胺和其他致癌性的联苯胺衍生物应用于临床化验法医检验刑事侦破及环境监测等领域。某研究小组欲利用燃烧法测定TMB的分子式(氮元素转化为N2)实验装置如图所示。回答下列问题:
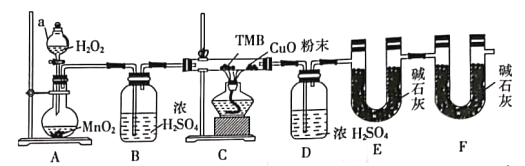
(1)实验装置两处用到装有碱石灰的干燥管,其中F处的目的是______________________。仪器a的名称是___________。
(2)将足量双氧水置于a中,圆底烧瓶中装入MnO2固体,按图连接好装置。
①A中发生反应的化学方程式为______________________。
②待B、D处导管口有均匀气泡时,再点燃C处酒精灯,原因是______________________。
(3)装置C中CuO粉末的作用为_________________________________。
(4)该实验___________(填“需要”或“不需要”)尾气处理,其原因是____________________。
(5)理想状态下,将4.80gTMB样品完全氧化,点燃C处酒精灯,实验结束时测得D增加3.60g,E增加14.08g,则TMB的分子式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)广州亚运会“潮流”火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料。试回答下列问题:
①如图是一定量丙烷完全燃烧生成CO2和1 mol H2O(l)过程中的能量变化图,请在图中的括号内填入“+”或“-”_____。

②写出表示丙烷燃烧热的热化学方程式:___________________________________。
③二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1 mol二甲醚完全燃烧生成CO2和液态水放出1 455 kJ热量。若1 mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1835 kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为_______。
(2)科学家盖斯曾提出:“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的。”利用盖斯定律可测某些特别反应的热效应。
①P4(s,白磷)+5O2(g)===P4O10(s) ΔH1=-2 983.2 kJ·mol-1
②P(s,红磷)+5/4O2(g)===1/4P4O10(s) ΔH2=-738.5 kJ·mol-1
则白磷转化为红磷的热化学方程式为_________________________________________。相同的状况下,能量较低的是________;白磷的稳定性比红磷________(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟甲香豆素( )是一种治疗胆结石的药物,下列说法正确的是
)是一种治疗胆结石的药物,下列说法正确的是
A. 分子中的两个苯环都可以发生加成反应
B. 二氯代物超过两种
C. 1mol羟甲香豆素与氢气加成,最多需要5molH2
D. 所有原子均处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,书写正确的是( )。
A.铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
B.稀硫酸与氢氧化钡溶液反应:Ba2++H++OH-+![]() =H2O+BaSO4↓
=H2O+BaSO4↓
C.碳酸钙与稀盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O
D.铜片跟硝酸银溶液反应:Cu+Ag+=Cu2++Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为常温下向10mL0.1 mol·L-1 NH3·H2O中加入等浓度的盐酸时,NH3·H2O的物质的量随V(盐酸)的变化曲线。(电离度为已电离的NH3H2O占初始时NH3H2O的百分比),下列说法正确的是( )

A. 测得a点时溶液的pH=11,则NH3·H2O的电离度为1%
B. b点时溶液的pH=7
C. 水的电离程度:b<c
D. c点时溶液中存在关系式:2c(Cl-)=c(NH4+) +c(NH3H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三元电池成为2018年我国电动汽车的新能源,其电极材料可表示为Li![]() x
x![]() y
y![]() zO2且x+y+z=1。充电时电池总反应为LiNixCoyMnzO2+6C(石墨)═Li1-aNixCoyMnzO2+LiaC6,其电池工作原理如图,两极之间有一个允许特定离子X通过的隔膜。下列说法正确的是( )
zO2且x+y+z=1。充电时电池总反应为LiNixCoyMnzO2+6C(石墨)═Li1-aNixCoyMnzO2+LiaC6,其电池工作原理如图,两极之间有一个允许特定离子X通过的隔膜。下列说法正确的是( )

A.允许离子X通过的隔膜属于阴离子交换膜
B.充电时,Li+被氧化
C.可从无法充电的废旧电池的石墨电极中回收大量金属锂
D.放电时,正极反应式为Li1-aNixCoyMnzO2+aLi+ +ae-═LiNixCoyMnzO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com