

| ||
| ||
| 11200m |
| V |
| 11200m |
| V |
| ||
| ||
| V×10-3L |
| 22.4L/mol |
| V |
| 22400 |
| m |
| Mr |
| V |
| 22400 |
| 11200m |
| V |
| 11200m |
| V |


 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
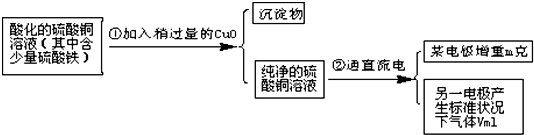
| 浓H2SO4△ |
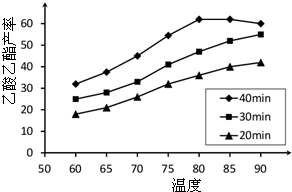
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
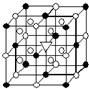 A.(1)右图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽图中●、○中的一种.图中●、○分别指代哪种粒子
A.(1)右图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽图中●、○中的一种.图中●、○分别指代哪种粒子| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
| 80m-135n |
| 18n |
| 80m-135n |
| 18n |
查看答案和解析>>
科目:高中化学 来源: 题型:
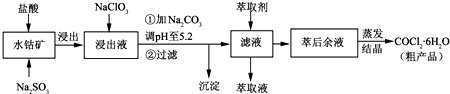
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
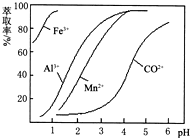
查看答案和解析>>
科目:高中化学 来源:2012届江苏省扬州中学高三3月双周练习(二)化学试卷(带解析) 题型:填空题
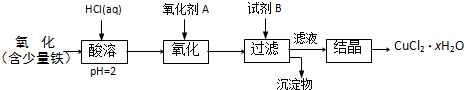
(20分)聚合氯化铝是一种新型、高效絮凝剂和净水剂,其单体是液态的碱式氯化铝[Al2(OH)nCl6-n]。本实验采用铝盐溶液水解絮凝法制备碱式氯化铝。其制备原料为分布广、价格廉的高岭土,化学组成为:Al2O3(25%~34%)、SiO2(40%~50%)、Fe2O3(0.5%~3.0%)以及少量杂质和水分。已知氧化铝有多种不同的结构,化学性质也有差异,且一定条件下可相互转化;高岭土中的氧化铝难溶于酸。制备碱式氯化铝的实验流程如下: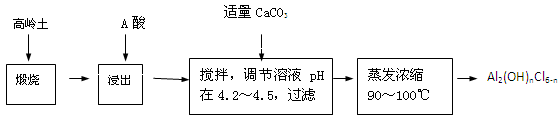
已知:Fe3+、Al3+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2。
根据流程图回答下列问题:
(1)“煅烧”的目的是_______________________________________________。
(2)“浸出”过程中发生反应的离子方程式为_______________________________。
(3)“浸出”选用的酸为_______。配制质量分数15%的A酸需要200mL30%的A酸(密度约为1.15g/cm3)和_______g蒸馏水,配制用到的仪器有烧杯、玻璃棒、______________。
(4)为提高铝的浸出率,可采取的措施有 _______________(要求写出三条)。
(5)“调节溶液pH在4.2~4.5”的过程中,除添加必要的试剂,还需借助的实验用品是_________________;“蒸发浓缩”需保持温度在90~100℃,控制温度的实验方法是___________ ______。
(6)实验中制备碱式氯化铝反应的化学方程式为_________________
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江苏省高三第二次模拟考试化学试卷 题型:填空题
(20分)聚合氯化铝是一种新型、高效絮凝剂和净水剂,其单体是液态的碱式氯化铝[Al2(OH)nCl6-n]。本实验采用铝盐溶液水解絮凝法制备碱式氯化铝。其制备原料为分布广、价格廉的高岭 土,化学组成为:Al2O3(25%~34%)、SiO2(40%~50%)、Fe2O3(0.5%~3.0%)以及少量杂质和水分。已知氧化铝有多种不同的结构,化学性质也有差异,且一定条件下可相互转化;高岭土中的氧化铝难溶于酸。制备碱式氯化铝的实验流程如下:
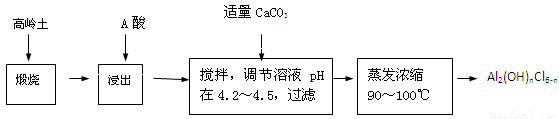
已知:Fe3+、Al3+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2。
根据流程图回答下列问题:
(1)“煅烧”的目的是_______________________________________________。
(2)“浸出”过程中发生反应的离子方程式为_______________________________。
(3)“浸出”选用的酸为_______。配制质量分数15%的A酸需要200mL30%的A酸(密度约为1.15g/cm3)和_______g蒸馏水,配制用到的仪器有烧杯、玻璃棒、______________。
(4)为提高铝的浸出率,可采取的措施有 _______________(要求写出三条)。
(5)“调节溶液pH在4.2~4.5”的过程中,除添加必要的试剂,还需借助的实验用品是_________________;“蒸发浓缩”需保持温度在90~100℃,控制温度的实验方法是___________ ______。
(6)实验中制备碱式氯化铝反应的化学方程式为_________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com