
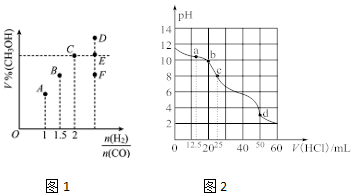
分析 (1)可逆反应到达平衡是,同种物质的正、逆速率相等(不同物质的正、逆速率之比等于期末化学计量数之比),各组分的含量、浓度等保持不变,判断平衡的物理量应随反应进行由变化到不再变化说明到达平衡;
(2)①由CO与氢气总物质的量、与$\frac{n({H}_{2})}{n(CO)}$=2可以计算CO与氢气各自的物质的量,利用三段式计算平衡时各组分物质的量、各组分物质的量变化量,根据v=$\frac{△c}{△t}$计算v(H2);
先计算该温度下平衡常数K,再计算浓度商Qc,与平衡常数K相比判断反应进行分析,可以确定氢气转化率变化;
②混合比例等于化学计量数之比时,平衡时生成物的含量最大;
Ⅱ、(1)根据电离常数可知草酸的酸性强于碳酸,则碳酸钠的水解程度大于草酸钠,等浓度草酸溶液和碳酸溶液中,氢离子浓度较大的是草酸,
草酸的二级电离常数均大于碳酸的,所以草酸的电离程度大于碳酸,且碳酸以第一步电离为主,因此溶液中c (H+)>c (HC2O4-)>c (C2O42-)>c (HCO3-)>c (CO32-);
(2)A.a点n(HCl)=0.1000mol/L×0.0125L=0.00125mol,n(Na2CO3)=0.1000mol/L×0.025L=0.0025mol,反应生成0.00125molNaHCO3,剩余0.00125molNa2CO3,NaCl为0.00125mol,碳酸根离子水解程度大于碳酸氢根离子;
B.b点时n(HCl)=0.1mol/L×0.02L=0.002mol,n(Na2CO3)=0.1000mol/L×0.025L=0.0025mol,由物料守恒可知5c(Cl-)=4c(HCO3-)+4c(CO32-)+4c(H2CO3);
C.c点时n(HCl)=0.1mol/L×0.025L=0.0025mol,恰好完全反应生成NaHCO3,根据质子守恒得c(OH-)+c(CO32-)=c(H+)+c(H2CO3);
D.d点n(HCl)=0.1000mol/L×0.050L=0.005mol,为碳酸钠物质的量的二倍,二者反应方程式为 Na2CO3+2HCl=2NaCl+CO2+H2O,溶液中的溶质为NaCl,会溶解部分二氧化碳,根据质子恒等式可判断;
Ⅲ、计算水解平衡常数Kh,再根据Ka=$\frac{{K}_{w}}{{K}_{h}}$计算.
解答 解:(1)A.单位时间内生成1mol CH3OH(g)的同时消耗了1mol CO(g),均表示正反应速率,反应始终按该比例关系进行,单位时间内生成1mol CH3OH(g)的同时生成了1mol CO(g)可以说明到达平衡,故A错误;
B.混合气体总质量不变,容器容积恒定,容器内混合气体的密度始终保持不变,故B错误;
C.在绝热恒容的容器中,随反应进行温度发生变化,平衡常数也随之发生变化,当反应的平衡常数不再变化时说明反应到达平衡,故C正确;
D.混合气体总质量不变,随反应进行混合气体总物质的量增大,则气体的平均摩尔质量进行,当气体的平均摩尔质量不再变化时,说明反应到达平衡,故D正确,
故选:CD;
(2)①H2和CO总共为3mol,且起始$\frac{n({H}_{2})}{n(CO)}$=2,可知H2为2mol、CO为1mol,5min达到平衡时CO的转化率为0.6,则:
CO(g)+2H2(g)?CH3OH(g)
起始(mol):1 2 0
变化(mol):0.6 1.2 0.6
平衡(mol):0.4 0.8 0.6
容器的容积为2L,则v(H2)=$\frac{\frac{1.2mol}{2L}}{5min}$=0.12mol/(L.min),该温度下平衡常数K=$\frac{\frac{0.6}{2}}{\frac{0.4}{2}×(\frac{0.8}{2})^{2}}$,此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,此时浓度商Qc=$\frac{\frac{0.6+0.4}{2}}{\frac{0.4+0.4}{2}×(\frac{0.8}{2})^{2}}$<K=$\frac{\frac{0.6}{2}}{\frac{0.4}{2}×(\frac{0.8}{2})^{2}}$,反应向正反应进行,达新平衡时H2的转化率将增大,
故答案为:0.12mol/(L.min);增大;
②混合比例等于化学计量数之比时,平衡时生成物的含量最大,故当$\frac{n({H}_{2})}{n(CO)}$=3.5时,达到平衡状态后,CH3 OH的体积分数小于C点,故选F;
Ⅱ、(1)根据电离常数可知草酸的酸性强于碳酸,则碳酸钠的水解程度大于草酸钠,所以0.1 mol/L Na2CO3溶液的pH大于0.1 mol/L Na2C2O4溶液的pH,
草酸的酸性强于碳酸,则等浓度草酸溶液和碳酸溶液中,氢离子浓度较大的是草酸,
草酸的二级电离常数均大于碳酸的,所以草酸的电离程度大于碳酸,且碳酸以第一步电离为主,因此溶液中c (H+)>c (HC2O4-)>c (C2O42-)>c (HCO3-)>c (CO32-),则AC正确,BD错误.
故答案为:AC;
(2)A.a点n(HCl)=0.1000mol/L×0.0125L=0.00125mol,n(Na2CO3)=0.1000mol/L×0.025L=0.0025mol,反应生成0.00125molNaHCO3,剩余0.00125molNa2CO3,NaCl为0.00125mol,碳酸根离子水解程度大于碳酸氢根离子,c(HCO3-)>c(Cl-)>c(CO32-),故A错误;
B.b点时n(HCl)=0.1mol/L×0.02L=0.002mol,n(Na2CO3)=0.1000mol/L×0.025L=0.0025mol,由物料守恒可知5c(Cl-)=4c(HCO3-)+4c(CO32-)+4c(H2CO3),则5c(Cl-)>4c(HCO3-)+4c(CO32-),故B正确;
C.c点时n(HCl)=0.1mol/L×0.025L=0.0025mol,恰好完全反应生成NaHCO3,根据质子守恒得c(OH-)+c(CO32-)=c(H+)+c(H2CO3),故C正确;
D.d点n(HCl)=0.1000mol/L×0.050L=0.005mol,为碳酸钠物质的量的二倍,二者反应方程式为 Na2CO3+2HCl=2NaCl+CO2+H2O,溶液中的溶质为NaCl,会溶解部分二氧化碳,根据质子恒等式可知,c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),故D错误;
故选:BC;
Ⅲ、常温下,0.1mol/L的HCOONa溶液pH为10,溶液中存在HCOO-水解HCOO-+H2O?HCOOH+OH-,故Kh=$\frac{1{0}^{-4}×1{0}^{-4}}{0.1-1{0}^{-4}}$=10-7,则HCOOH的电离常数Ka=$\frac{{K}_{w}}{{K}_{h}}$=$\frac{1{0}^{-14}}{1{0}^{-7}}$=1×10-7,故答案为:1.0×10-7.
点评 本题综合性较大,涉及反应热计算、化学平衡状态判断、化学平衡图象与化学平衡有关计算、平衡常数、氧化还原反应等,属于拼合型题目,需要学生具备扎实的基础与灵活运用能力.


科目:高中化学 来源: 题型:选择题
| A. | 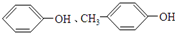 | B. | 甲苯和C3H8O3 | ||
| C. | CH4、C2H4O2 | D. | C3H4、C3H6O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙醇是一种重要的有机化工原料,它可以用玉米、薯类等为原料发酵、蒸馏制成.乙醇和汽油经加工处理形成的车用燃料即乙醇汽油.
乙醇是一种重要的有机化工原料,它可以用玉米、薯类等为原料发酵、蒸馏制成.乙醇和汽油经加工处理形成的车用燃料即乙醇汽油.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y单质能溶于X元素的最高价氧化物的水化物 | |
| B. | W2能与H2Z发生置换反应 | |
| C. | 离子半径由大到小:Z2->X+>Y3+>W2- | |
| D. | W、X形成两种离子化合物,阴、阳离子个数比一定是1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室利用锌片和稀硫酸制H2时,在稀硫酸中滴加MgSO4溶液可以加快反应速率 | |
| B. | 将反应2FeCl3+Cu═2FeCl2+CuCl2设计为原电池,正极反应为Cu-2e-═Cu2+ | |
| C. | 利用电解法除去酸性废水中的CN-离子,CN-在阳极被还原为N2和CO2 | |
| D. | 利用电解法精炼铜,原粗铜中的杂质有以离子形式被除去,也有以单质形式被除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
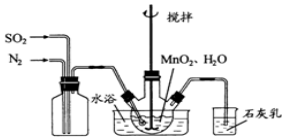
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com