
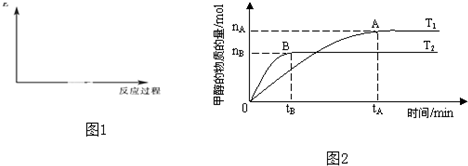
| nA |
| tA |
| C(H2O)?C(CH3OH) |
| C(CO2)?C(H2) |
| nH2 |
| nCH3OH |
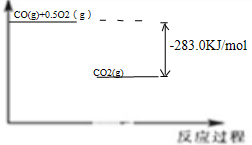 ;
;
| ||
| tA |
| nA |
| 2tA |
| C(CH3OH)C(H2O) |
| C(CO2)C3(H2) |
| n(H2) |
| n(CH3OH) |


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
| A、溶液的体积10V甲≥V乙 |
| B、水电离出的OH-浓度:10c(OH-)甲≤c(OH-)乙 |
| C、若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲≤乙 |
| D、若分别与5 mL pH=11的NaOH溶液反应,所得溶液的pH:甲≤乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽,用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液.下列说法正确的是( )
现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽,用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液.下列说法正确的是( )| A、从A口出来的是H2SO4溶液 |
| B、阳极反应式为2H++2e-═H2↑ |
| C、a是阳离子交换膜,允许H+通过 |
| D、Na2SO4溶液从E口加入 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示的甲、乙、丙三种晶体,试写出:
如图所示的甲、乙、丙三种晶体,试写出:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com