
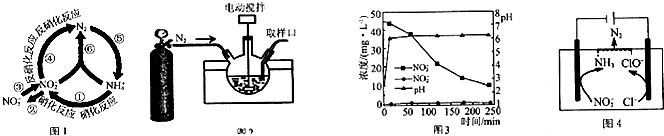
分析 (1)将游离态的氮(即氮气)转化为化合态的氮(即氮的化合物)的过程,叫做氮的固定;
(2)①2NH4+(aq)+3O2═2NO2-(aq)+4H+(aq)+2H2O(l)△H1=-556.8kj/mol
②2NO2-(aq)+O2(g)=2NO3-(aq);△H2=-145.2KJ•mol-1
依据盖斯定律计算(①+②)×$\frac{1}{2}$得到反应NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(1)热化学方程式;
(3)①反应Fe(H2O)62++2BH4-=Fe↓+2H3BO3+7H2↑,反应中铁元素化合价+2价降低为0价,B元素化合价为+3价,元素化合价不变,氢元素化合价-1价升高为0价,生成1molFe电子转移8mol;
②加入缓冲溶液维持pH6.2左右,NO3-主要还原为NH4+,Fe转化为Fe(OH)2,铁消耗氢离子发生腐蚀,酸性溶液中硝酸根离子氧化亚铁离子生成氢氧化亚铁,硝酸根离子被还原为铵根离子,结合电荷守恒和原子守恒配平书写离子方程式;
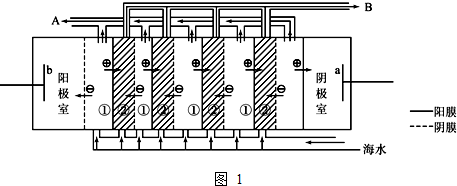
(4)①电解池中阴极上是NO3-被还原为NH3,失电子发生还原反应;
②氨气被次氯酸根离子氧化生成氮气,结合电荷守恒和原子守恒配平书写离子方程式.
解答 解:(1)分析转化关系可知,氮的固定是指单质变化为化合物的反应,所以图中属于氮的固定的是⑤,
故答案为:⑤;
(2)①2NH4+(aq)+3O2═2NO2-(aq)+4H+(aq)+2H2O(l)△H1=-556.8kj/mol
②2NO2-(aq)+O2(g)=2NO3-(aq);△H2=-145.2KJ•mol-1
依据盖斯定律计算(①+②)×$\frac{1}{2}$得到反应NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(1)△H3=-351KJ/mol,
故答案为:-351;
(3)①反应Fe(H2O)62++2BH4-=Fe↓+2H3BO3+7H2↑,反应中铁元素化合价+2价降低为0价,B元素化合价为+3价,元素化合价不变,氢元素化合价-1价升高为0价,生成1molFe电子转移8mol,
故答案为:8mol;
②加入缓冲溶液维持pH6.2左右,NO3-主要还原为NH4+,Fe转化为Fe(OH)2,铁消耗氢离子发生腐蚀,酸性溶液中硝酸根离子氧化亚铁离子生成氢氧化亚铁,硝酸根离子被还原为铵根离子,结合电荷守恒和原子守恒配平书写离子方程式为:4Fe+NO3-+5H2O+2H+=4Fe(OH)2+NH4+,
故答案为:4Fe+NO3-+5H2O+2H+=4Fe(OH)2+NH4+;
(4)①电解池中阴极上是NO3-被还原为NH3,失电子发生还原反应,电极反应为NO3-+6H2O+8e-=NH3+9OH-,
故答案为:NO3-+6H2O+8e-=NH3+9OH-;
②氨气被次氯酸根离子氧化生成氮气,反应的离子方程式为:2NH3+3ClO-=N2+3Cl-+3H2O,
故答案为:2NH3+3ClO-=N2+3Cl-+3H2O.
点评 本题考查了含氮物质性质、氧化还原反应、电解池原理分析、热化学方程式书写,主要是题干信息的理解应用,掌握基础是解题关键,题目难度较大.


科目:高中化学 来源: 题型:选择题
| A. | PbCO3 | B. | 2PbCO3•Pb(OH)2 | C. | Pb(OH)2 | D. | (CH3COO)2Pb |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
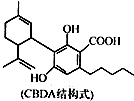
| A. | 1个CBDA分子中含有2个手性碳原子 | |
| B. | 1 mol CBDA 最多可与2molBr2反应 | |
| C. | 1 mol CBDA最多可与3 mol NaHCO3反应 | |
| D. | 1 mol CBDA最多可与2mol H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.2mol/L | B. | 1.4mol/L | C. | 1.7mol/L | D. | 1.9mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | 溶液颜色褪至无色所需时间/s | ||
| 浓度 /mol•L-1 | 体积 /mL | 浓度 /mol•L-1 | 体积 /mL | |||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 | t1 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 | t2 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 | t3 |
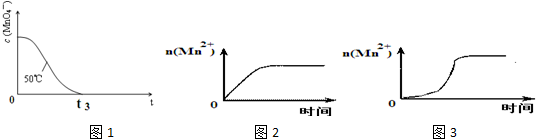
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度 /℃ | 再向试管中加入少量固体 | 溶液颜色褪至无色所需时间/s | ||
| 浓度 /mol•L-1 | 体积 /mL | 浓度 /mol•L-1 | 体积 /mL | ||||
| ④ | 0.10 | 2.0 | 0.010 | 4.0 | 25 | MnSO4 | t4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| C(I-)/(mol•L-1) | C(Fe3+)/(mol•L-1) | ν/(mol•(L•s)-1) | |
| ① | 0.20 | 0.80 | 0.032k |
| ② | 0.60 | 0.40 | 0.144k |
| ③ | 0.80 | 0.20 | 0.128k |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com