
分析 (1)FeS2+C+O2→Fe3O4+CO+S中,Fe、C、S元素的化合价升高,O元素的化合价降低,结合电子、原子守恒分析;
(2)①浓盐酸易挥发;
②用稀盐酸和锌粒反应制取氢气,H元素的化合价由+1价降低为0,且生成盐;
③用盐酸除去铁表面的铁锈,反应生成氯化铁和水,氯化铁为盐;
④2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价降低,Cl元素的化合价升高.
解答 解:(1)FeS2+C+O2→Fe3O4+CO+S中,Fe、C、S元素的化合价升高,O元素的化合价降低,FeS2、C均为还原剂被氧化,结合电子、原子守恒可知反应为3FeS2+2C+3O2═Fe3O4+2CO+6S,由 反应可知,生成6molS时,5mol还原剂被氧化,则生成3mol硫,被氧化的物质的物质的量为2.5 mol,
故答案为:3FeS2+2C+3O2═Fe3O4+2CO+6S;2.5mol;
(2)①浓盐酸易挥发,则浓盐酸长时间露置在空气中,溶液的质量减轻,故答案为:d;
②用稀盐酸和锌粒反应制取氢气,H元素的化合价由+1价降低为0,且生成盐,则盐酸表现氧化性和酸性,离子反应为Zn+2H+═Zn2++H2↑,
故答案为:ab;Zn+2H+═Zn2++H2↑;
③用盐酸除去铁表面的铁锈,反应生成氯化铁和水,氯化铁为盐,则盐酸表现酸性,离子反应为,故答案为:a;Fe2O3+6H+═2Fe3++3H2O;
④2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价降低,则Mn元素被还原,Cl元素的化合价升高,则HCl为还原剂,失去电子被氧化,对应氧化产物为Cl2,故答案为:Mn;HCl;Cl2.
点评 本题考查物质的性质及氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题

 .
.
 +CaCl2+H2O
+CaCl2+H2O
| 实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中 试剂 | 有机层的 厚度/cm |
| A | 2mL乙醇、1mL乙酸、1mL18mol•L-1 浓硫酸 | 饱和Na2CO3 溶液 | 3.0 |
| B | 2mL乙醇、1mL乙酸 | 0.1 | |
| C | 2mL乙醇、1mL乙酸、3mL 2mol•L-1 H2SO4 | 0.6 | |
| D | 2mL乙醇、1mL乙酸、盐酸 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图1是一套实验室制取乙烯验证乙烯具有还原性的实验装置,请回答:
如图1是一套实验室制取乙烯验证乙烯具有还原性的实验装置,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 1mol该有机物能与足量金属钠反应放出1molH2 | |
| B. | 能与乙醇发生酯化反应 | |
| C. | 1mol该有机物在催化剂作用下最多能与1molH2发生还原反应 | |
| D. | 1mol该有机物能与足量NaHCO3溶液反应放出2 molCO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molO2与H2的混合气体中含有的分子数为NA | |
| B. | 1.7g NH3所含原子数为0.1NA | |
| C. | 通常状况下,11.2L N2中含有的原子数目为NA | |
| D. | 标准状况下,22.4L H2O中含有的氧原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
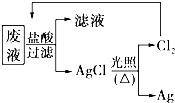 国务院强调“南水北调”工程必须坚持“三先三后”的原则.在调水工程中,沿途工业污水的任意排放是造成水质恶化的最大隐患.检测某工厂废液中,含有大量的Mg2+、Al3+、Cu2+、Ag+.试分析回答下列问题:
国务院强调“南水北调”工程必须坚持“三先三后”的原则.在调水工程中,沿途工业污水的任意排放是造成水质恶化的最大隐患.检测某工厂废液中,含有大量的Mg2+、Al3+、Cu2+、Ag+.试分析回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com