
| A. | Fe、Cu元素在白然界中主要以化合态形式存在 | |
| B. | CO在高温下能将Fe203还原为Fe | |
| C. | Fe与盐酸、Fe与Cl2发生反应均生成FeCl3 | |
| D. | 制作印刷电路板时,可用FeCl3溶液腐蚀Cu |
分析 A、铁是活泼金属易和空气中氧气,水蒸气等物质发生反应;
B、一氧化碳还原氧化铁为铁;
C、铁和盐酸反应生成氯化亚铁和氢气;
D、氯化铁和铜反应,能溶解线路板上的铜为氯化铜;
解答 解:A、铁铜是金属,易和空气中氧气,水蒸气等物质发生反应,生成氧化物,自然界中主要是化合态,故A正确;
B、一氧化碳还原氧化铁为铁,是工业冶炼铁的原理,故B正确;
C、铁和盐酸反应生成氯化亚铁和氢气,Fe与Cl2发生反应生成FeCl3,故C错误;
D、氯化铁和铜反应,能溶解线路板上的铜为氯化铜,可以制备印刷电路板,故D正确;
故选C.
点评 本题考查了金属性质和存在,物质性质的理解应用,掌握基础是解题关键,题目难度中等.


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:解答题
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2[来源:] | n3 |
| n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•mol?1 | 412.5 | 348 | 612 | 436 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  盐桥中的K+移向ZnSO4溶液 | |
| B. | 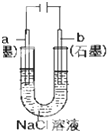 工作一段时间后,a极附近溶液的C(OH-)增大 | |
| C. | 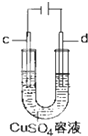 工作时,c极为发生氧化反应 | |
| D. |  电子由Zn流向Fe,装置中有Fe2+生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 在容积恒定的密闭容器中进行反应 2NO+O2=2NO2 该反应的反应速率随时间变化的关系如图所示.若t2、t4时刻只改变一个条件,下列说法正确的是( )
在容积恒定的密闭容器中进行反应 2NO+O2=2NO2 该反应的反应速率随时间变化的关系如图所示.若t2、t4时刻只改变一个条件,下列说法正确的是( )| A. | 在t5时,容器NO2的体积分数是整个过程中的最大值 | |
| B. | 在t2时,采取的措施可以是增大压强 | |
| C. | 在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态 | |
| D. | 在t1~t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④③②① | B. | ④①②③ | C. | ①③②④ | D. | ③①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 标准状况下当甲中产生4.48 L气体时,丙中Cu电极质量增加21.6g | |
| B. | 电解过程中丙中溶液pH无变化 | |
| C. | 向甲中加入适量的盐酸,可使溶液恢复到电解前的状态 | |
| D. | 乙中左侧电极反应式:Cu2++2e-═Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有溴化银沉淀生成 | B. | 氯化银河溴化银沉淀等量生成 | ||
| C. | 氯化银沉淀多于溴化银沉淀 | D. | 氯化银沉淀少于溴化银沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com