
在以下所列各对化合物中,可看作高分子化合物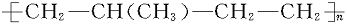 的单体的是 ( )
的单体的是 ( )
A.CH3—CH=CH2和CH2 CH—CH=CH2
CH—CH=CH2
B.CH2=CH2和CH2=CH—CH=CH2
C.CH3—CH2—CH=CH2和CH2=CH—CH3
D.CH2=CH2和CH2=CH—CH3
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
Q、R、T、M、W五种短周期元素在周期表中的相对位置如图所示,其中M的原子序数是R的原子序数的2倍。下列说法正确的是 ( )
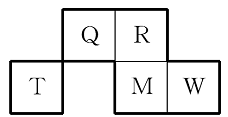
A.原子半径大小顺序为r(Q)>r(R)>r(T)>r(M)>r(W)
B.Q、W的单核离子的核外电子数相等
C.五种元素均能形成氢化物
D.W的氢化物水溶液酸性最强,说明W的非金属性在五种元素中最强
查看答案和解析>>
科目:高中化学 来源: 题型:
一定质量的某有机物与足量金属钠反应,可得VAL气体。相同质量的该有机物与适量的Na2CO3浓溶液反应,可得VBL气体。已知在同温、同压下VA和VB不相同,则该有机物可能是 ( )
①CH3CH(OH)COOH
②HOOC—COOH
③CH3CH2COOH
④HOOCCH2CH(OH)CH2CH2OH
A.①② B.②③ C.③④ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是 ( )
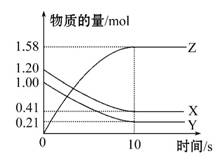
A.反应开始到10 s,用Z表示的反应速率为0.158 mol·L-1·s-1
B.10 s后,该反应停止进行
C.反应的化学方程式为2X(g)+Y(g) 2Z(g)
2Z(g)
D.反应开始到10 s时,平衡反应速率:v(X)=v(Y)=0.039 5 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关煤、石油、天然气等资源的说法正确的是
( )
A.石油裂解得到的汽油是纯净物
B.石油产品都可发生加成反应
C.天然气是一种清洁的化石燃料
D.煤就是碳,属于单质
查看答案和解析>>
科目:高中化学 来源: 题型:
下列四种盐酸溶液,均能跟锌片反应,其中最初反应速率最快的是 ( )
A.10℃20 mL 3 mol·L-1的盐酸溶液
B.20℃30 mL 2 mol·L-1的盐酸溶液
C.20℃20 mL 2 mol·L-1的盐酸溶液
D.20℃10 mL 4 mol·L-1的盐酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
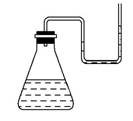 有下列物质:①NaOH固体;②浓硫酸;③NH4NO3晶体;④CaO固体。现将它们分别装入有水的锥形瓶里,立即塞紧带U形管的塞子,发现U形管内的滴有红墨水的水面呈如图所示状态,判断加入的物质可能是 ( )
有下列物质:①NaOH固体;②浓硫酸;③NH4NO3晶体;④CaO固体。现将它们分别装入有水的锥形瓶里,立即塞紧带U形管的塞子,发现U形管内的滴有红墨水的水面呈如图所示状态,判断加入的物质可能是 ( )
A.①②③④ B.①②④
C.②③④ D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2% H2O2溶液 | 无 |
| ② | 10 mL 5% H2O2溶液 | 无 |
| ③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
| ④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
| ⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是__________________________________。
(2)常温下5% H2O2溶液的pH约为6,H2O2的电离方程式为____________________。
(3)实验①和②的目的是_________________________________________________。
实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是_______________________。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图。

分析上图能够得出的实验结论是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
装置Ⅰ和装置Ⅱ、装置Ⅲ是有关硝酸和铜反应的实验装置示意图:
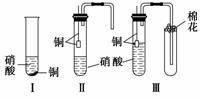
(1)若用装置Ⅰ进行铜与浓硝酸反应的实验,最大的缺点是____________________;
若用装置Ⅰ来证明铜与稀硝酸反应生成NO气体,其最大缺点是不能与浓硝酸跟铜反应形成鲜明对照。简述原因_____________________________________________________。
(2)若用装置Ⅱ进行适当操作,即可克服上述缺点,还能使上述两反应在同一试管中先后连续进行。实验步骤如下:
步骤一:组装好装置并______________后,加入2 mL浓硝酸(铜片接近酸液),塞紧胶塞。
步骤二:________________(操作)使反应发生。当导管口有少量红棕色气体逸出时,__________________________________________(操作)使反应停止。同时将导管插入水中。稍后能观察到:a.水沿导管倒吸至试管中;还可能观察到下列________(填序号)等明显现象;b.溶液由蓝色变为无色;c.铜片表面产生气泡;d.红棕色气体变为无色。请解释产生现象a的原因________________________________________________________________________
________________________________________________________________________。
步骤三:当试管中溶液体积约占试管容积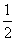 时,此时铜片与溶液接触,从水中抽出导管,并伸入一试管中,管口塞上浸有浓碱液的棉花(如装置Ⅲ)。这样做的目的是_______和__________________。
时,此时铜片与溶液接触,从水中抽出导管,并伸入一试管中,管口塞上浸有浓碱液的棉花(如装置Ⅲ)。这样做的目的是_______和__________________。
步骤四:反应完毕后……
(3)上述实验“步骤四”中反应完毕后还需要进行的操作是_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com