
| 弱酸 | HF | HClO | H2CO3 |
| 电离常数 25℃ | 3.53×10-4 | 2.95×10-8 | K1=4.4×10-7 K2=4.7×10-11 |
| A、2ClO-+H2O+CO2=2HClO+CO22- |
| B、等物质的量浓度的 NaHCO3 和 NaClO 的混合溶液中,c(HCO3-)<c(ClO-) |
| C、等物质的量浓度的 NaHCO3 溶液和 Na2CO3 溶液中离子数目一定不相同 |
| D、等物质的量浓度的 NaF 和 NaClO 溶液中所含离子总浓度前者大于后者 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 加入试剂 | 被检出物质的化学式 | 离子方程式 |
| 水 |
| 加入试剂 | 被检出物质的化学式 | 离子方程式 |
| 加入试剂 | 被检出物质的化学式 | 离子方程式 |
查看答案和解析>>
科目:高中化学 来源: 题型:
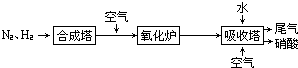
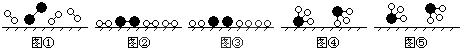
 、
、 、
、 分别表示N2、H2、NH3,图⑤表示生成的NH3离开催化剂表面,则图③的含义是
分别表示N2、H2、NH3,图⑤表示生成的NH3离开催化剂表面,则图③的含义是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定含有甲烷 |
| B、一定含有乙烯 |
| C、可能含有甲烷 |
| D、不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、取少量卤代烃加入NaOH水溶液共热,冷却,再加入AgNO3溶液检验卤代烃中卤原子的存在 |
| B、淀粉用酸催化水解后的溶液加入新制银氨溶液,水浴加热,来检验葡萄糖 |
| C、通过红外光谱分析可以区分乙醇和乙酸乙酯 |
| D、用新制CaO检验乙醇中是否含有水分 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所含的分子数相等 |
| B、在同温同压下,V(N2)═V(NO) |
| C、所含的原子数不相等 |
| D、在同温同体积下,p(N2)<p(NO) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com