
���� ��1��������Ӧ��NaHCO3+HCl=NaCl+H2O+CO2�������ݷ���ʽ���㣻
��2������Al��OH��3+3HCl=AlCl3+3H2O����10Ƭθ��ƽ�к�HCl���ʵ������ٸ����к�HCl���ʵ�����ȼ���10Ƭθ��ƽ�൱С�մ��Ƭ����
��3����������ǡ����ȫ��Ӧ���ɶ�����̼��AlCl3��MgCl2������̼ԭ���غ���������̼����������������غ��֪n��HCl��=3n��AlCl3��+2n��MgCl2������������������������
��� �⣺��1��2ƬС�մ�Ƭ�к���̼�����Ƶ�����Ϊ��0.5g��2=1g��
�豻�к͵�HCl���ʵ���Ϊn��HCl������
NaHCO3 +HCl=NaCl+H2O+CO2��
84g 1mol
1g n��HCl��
n��HCl��=$\frac{1mol��1g}{84g}$��0.012mol��
��n��H+��=n��HCl��=0.012mol��
�ʴ�Ϊ��0.012��
��2��10Ƭθ��ƽ����������������Ϊ10��0.245g=2.45g��
Al��OH��3+3HCl=AlCl3+3H2O
78g 3mol
2.45g x
����x=$\frac{3mol��2.45g}{78g}$��0.094mol
��10Ƭθ��ƽ�൱��С�մ��Ƭ��Ϊ��$\frac{0.094mol}{\frac{0.012mol}{2}}$=1.57
�ʴ�Ϊ��1.57��
��3��3.01g Al2Mg6��OH��16CO3•4H2O�����ʵ���Ϊ$\frac{3.01g}{��54+24��6+17��16+60+18��4��g/mol}$=0.005mol����������ǡ����ȫ��Ӧ���ɶ�����̼��AlCl3��MgCl2��
����̼ԭ���غ㣬���ɶ�����̼Ϊ0.005mol����������Ϊ0.005mol��22.4L/mol=0.112L��
�����������غ��֪n��HCl��=3n��AlCl3��+2n��MgCl2��=3��0.005mol��2+2��0.005mol��6=0.09mol��
�ʼ����������Ϊ$\frac{0.09mol}{2mol/L}$=0.045L=45mL��
�����ɶ�����̼���Ϊ0.112L�������������Ϊ45mL��
���� ���⿼�黯ѧ����ʽ�Ļ������㣬��Ŀ�Ѷ��еȣ������˻�ѧ�������е�Ӧ�ã�����������ѧ���ķ�����������������ѧ����������


 ̽���빮�̺��Ͽ�ѧ����������ϵ�д�
̽���빮�̺��Ͽ�ѧ����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
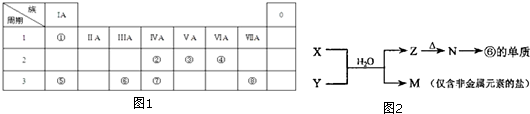
 ��
��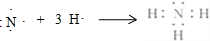
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C2H6��C3H8û��ͬ���칹�壬CH2O2��C2H4O2����ͬϵ�� | |
| B�� | һ�������£��������������ۡ������ʡ���ϩ������ˮ����ˮ�ⷴӦ | |
| C�� | һ�������£���ȫȼ��14g������������Ϊa����ϩ����ȩ������壬������ˮ������Ϊ18��1-a��g | |
| D�� | ȫ�������ϣ� �����ɵ��廷�����飨 �����ɵ��廷�����飨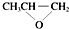 ����CO2�����Ƶ� ����CO2�����Ƶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ѧ����Ϊ�Ҵ� | B�� | �ӷ� | ||
| C�� | �������л��ܼ� | D�� | ���ܱ����Ը���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 5%������Һ | B�� | 75%�Ҵ���Һ | ||
| C�� | 0.5mol/LNaCl��Һ | D�� | 1mol/LNaCl��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ͬ��ͬѹ�£���������SO2��CO2�ܶȱ�Ϊ11��16 | |
| B�� | ͬ��ͬѹ�£���������SO2��CO2�����Ϊ1��1 | |
| C�� | �����ʵ����������ͺ�����ͬ��ͬѹ�¾�����ȵ������� | |
| D�� | ��״��������Ħ���������22.4L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��100mL 18.4mol•L-1Ũ�����м���1.2gľ̿�ۣ�����ʹ֮��ַ�Ӧ��������ͼ��װ��ͼ����ʵ�飬���μ��鷴Ӧ�õ��IJ����ش��������⣺
��100mL 18.4mol•L-1Ũ�����м���1.2gľ̿�ۣ�����ʹ֮��ַ�Ӧ��������ͼ��װ��ͼ����ʵ�飬���μ��鷴Ӧ�õ��IJ����ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
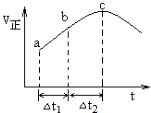
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ̼������ȷֽ� | B�� | �Ҵ�ȼ�� | ||
| C�� | ���������������к� | D�� | ����������ˮ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com