
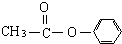 、
、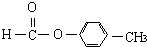 外还有四种,请分别写出结构简式:
外还有四种,请分别写出结构简式:| m |
| n |
| 0.34g |
| 0.0025mol |
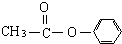

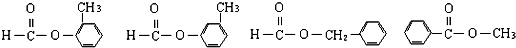 ;
;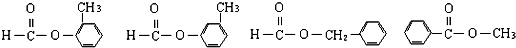 .
.


科目:高中化学 来源: 题型:
| A、1mol/L |
| B、2mol/L |
| C、3 mol/L |
| D、4 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (g)
(g)| Pt-Sn/Al2O3 |
| 高温 |
 (g)+3H2(g)
(g)+3H2(g)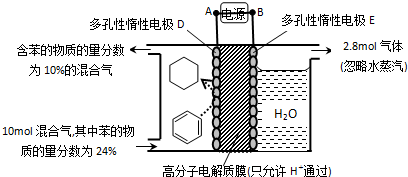
| 生成目标产物消耗的电子数 |
| 转移的电子总数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
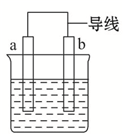 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol/L |
| B、1.5mol/L |
| C、2mol/L |
| D、2.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D |
 | 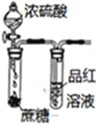 | 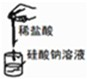 | 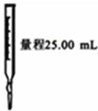 |
| 实验室利用氯化铵制取并收集NH3 | 说明浓H2SO4有脱水性、酸性、氧化性,SO2有漂白性 | 验证非金属性Cl>C>Si | 量取0.1mol?L-1KOH溶液20.00mL |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com