
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、E是中学化学的常见物质,其中X、Y、Z均含同一种元素,在一定条件下相互转化的关系如图所示(部分反映的条件和H2O已略去).若E为酸性气体,Z为发酵粉的主要成分之一,Y、Z能水解且溶液均呈碱性,则Z的俗称是小苏打,Z的一种工业上的重要制取方法是:在饱和氯化钠溶液中先通入NH3,再通入CO2.
X、Y、Z、E是中学化学的常见物质,其中X、Y、Z均含同一种元素,在一定条件下相互转化的关系如图所示(部分反映的条件和H2O已略去).若E为酸性气体,Z为发酵粉的主要成分之一,Y、Z能水解且溶液均呈碱性,则Z的俗称是小苏打,Z的一种工业上的重要制取方法是:在饱和氯化钠溶液中先通入NH3,再通入CO2.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原NaOH溶液的浓度是1.00mol/L,所得固体是Na2CO3 | |
| B. | 原NaOH溶液的浓度是0.500mol/L,所得固体是Na2CO3和NaHCO3 | |
| C. | 原NaOH溶液的浓度是1.00mol/L,所得固体是Na2CO3和NaOH | |
| D. | 原NaOH溶液的浓度是0.90mol/L,所得固体是Na2CO3和NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
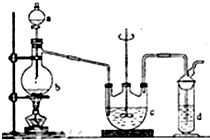 硫代硫酸钠(Na2S2O3)俗名大苏打,可用做分析试剂.它易溶于水,难溶于酒精,受热、遇酸易分解.工业上可用硫化碱法制备,反应原理:
硫代硫酸钠(Na2S2O3)俗名大苏打,可用做分析试剂.它易溶于水,难溶于酒精,受热、遇酸易分解.工业上可用硫化碱法制备,反应原理:| 实验序号 | 1 | 2 | 3 |
| Na2S2O3溶液体积(mL) | 19.98 | 20.02 | 21.18 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 种 | B. | 2 种 | C. | 3 种 | D. | 4 种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com