
【题目】某地温泉中富含硫、铜、锌等,可以治疗皮肤病。这里的“硫、铜、锌”指的是( )
A.分子B.原子C.元素D.单质
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1mol/(Lmin).求:
(1)此时A的浓度c(A)=mol/L,反应开始前容器中的A,B的物质的量:n(A)=n(B)=mol;
(2)B的平均反应速率v(B)=mol/(Lmin);
(3)x的值为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲用物质的量浓度为0.100 0molL﹣1的盐酸测定未知物质的量浓度的氢氧化钠溶液,选择酚酞作指示剂.请填写下列空白:
(1)用标准的盐酸滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,直到因加入一滴盐酸,溶液 , 立即停止滴定.
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是(填序号).
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
E.滴定过程中,锥形瓶的振荡过于激烈,使少量溶液溅出
(3)若某次滴定结束时,酸式滴定管中的液面如图所示,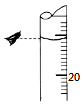
则读数为 mL.若仰视,会使读数偏(填“大”或“小”).
(4)再结合表数据,计算被测氢氧化钠溶液的物质的量浓度是 molL﹣1 .
滴定 | 待测溶液 | 标准酸体积 | |
滴定前的刻度/mL | 滴定后的刻度/mL | ||
第一次 | 10.00 | 1.34 | 19.39 |
第二次 | 10.00 | 4.10 | 21.10 |
第三次 | 10.00 | 0.40 | 17.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-选修5:有机化学基础]2017年治疗膀胱癌的有机小分子药物Aminolevulinic acid被批准使用,其合成路线如下:

已知:
请回答:
(1)A的名称为________,G中含氧官能团的名称为____________________________。
(2)⑤的反应类型为____________________,H的分子式为_____________________________。(3)①的化学方程式为__________________________________________。
(4)④的化学方程式为______________________________________________。
(5)D的同分异构体中,同时满足下列条件的共有____种(不含立体异构);
a.能与Na反应产生气体
b.既能发生银镜反应,又能发生水解反应
其中核磁共振氧谐有4组峰的物质的结构简式为________________(任写一种)。
(6)参照上述合成路线,设计由2-甲基丙酸和甲醇为起始原料制备2-甲基丙烯酸甲酯的合成路线(无机试剂任选)______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)![]() NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g) ![]() H2(g)+I2(g)达到平衡时,c(H2)=1 mol·L-1,c(HI)=4 mol·L-1,则此温度下反应①的平衡常数为( )
H2(g)+I2(g)达到平衡时,c(H2)=1 mol·L-1,c(HI)=4 mol·L-1,则此温度下反应①的平衡常数为( )
A. 36 B. 24 C. 16 D. 9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)地下钢管连接镁块是金属防腐措施中的________________________法。
(2)铅及其化合物可用于蓄电池,耐酸设备及X射线防护材料等。回答下列问题:
①铅是碳的同族元素,比碳多4个电子层。铅在元素周期表的位置为_______________________;铅的最高价氧化物对应水化物的酸性比碳酸的_______(填“强”或“弱”)。
②PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为___________________________。
③铅蓄电池放电时的正极反应式为__________________________________________ ,当电路中有2mol电子转移时,理论上两电极质量变化的差为_______ g。
(3)NO2、O2和熔融NaNO3可制作燃料电池,其原理见下图,石墨Ⅰ为电池的________极;该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,其电极反应式为__________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知破坏1mol H﹣H键、1mol I﹣I键、1mol H﹣I键分别需要吸收的能量为436kJ、151kJ、299kJ.则由氢气和碘单质反应生成2mol HI需要放出kJ的热量.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据问题填空:
(1)CO(g)+2H2(g)CH3OH(g)△H
如表所列数据是反应在不同温度下的化学平衡常数(K).
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①由表中数据判断该反应的△H0(填“>”、“=”或“<”).能够说明某温度下该反应是平衡状态的是
A.体系的压强不变 B.密度不变 C.混合气体的相对分子质量 D.c(CO)=c(CH3OH)
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,计算此温度下的平衡常数K=(保留3为有效数字)
(2)在某温度和压强下,将一定量H2和O2充入密闭容器发生反应:
2H2(g)+O2(g)2H2O(g)△H=﹣241.8KJ/mol,平衡后压缩容器体积至原来的 ![]() ,其他条件不变,对平衡体系产生的影响是 (填序号):
,其他条件不变,对平衡体系产生的影响是 (填序号):
a.平衡常数K增大; b.正反应速率加快,逆反应速率减慢; c.重新平衡c(H2)/c(H2O)减小.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】法国里昂的科学家最近发现一种只由四个中子组成的微粒,这种微粒称为“四中子”,也有人称之为“零号元素”.它与天体中的中子星构成类似.有关:“四中子”微粒的说法正确的( )
A.该微粒的质量数为2
B.该微粒不显电性
C.它与普通中子互称为同位素
D.在元素周期表中与氢元素占同一位置
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com