
ǿ����ǿ���ϡ��Һ�����кͷ�Ӧ����ЧӦΪ��H+(aq)+OH-(aq)�TH2O��l����H=-57.3kJ/mol���ֱ���1L 0.5mol/L��NaOH��Һ�м��룺��ϡ�����Ũ�����ϡ���ᣬǡ����ȫ��Ӧʱ��ЧӦ�ֱ�Ϊ��H1����H2����H3�����ǵĹ�ϵ��ȷ����
A����H1����H2����H3 B����H1>��H3>��H2
C����H1<��H2<��H3 D����H1����H3����H2

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��㶫ʡ�߶������л�ѧ���������棩 ���ͣ�ѡ����
�����仯�����������������ϵ���С���֪t��ʱ����ӦFeO��s����CO��g�� Fe��s����CO2��g����ƽ�ⳣ��K��0.25������2 L�ܱ������м���0.02mol FeO��s������ͨ��xmolCO��t��ʱ��Ӧ�ﵽƽ�⡣��ʱFeO��s��ת����Ϊ50%����x��ֵΪ�� ��
Fe��s����CO2��g����ƽ�ⳣ��K��0.25������2 L�ܱ������м���0.02mol FeO��s������ͨ��xmolCO��t��ʱ��Ӧ�ﵽƽ�⡣��ʱFeO��s��ת����Ϊ50%����x��ֵΪ�� ��
A��0.1 B��0.05 C��0.04 D��0.02
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ�߶��Ͻο����Ļ�ѧ���������棩 ���ͣ�ѡ����
ijͬѧ�����յ����ŷ��Ϸ������ղؼ�ֵ����Ʊ���㽫��Ʊ����������ˮ�У���ȥ����Ʊ������ϼ������ݡ��������ܡ�ԭ�������ϼ��ijɷֿ����� ( )

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��ӱ�ʡ�߶������л�ѧ���������棩 ���ͣ�ʵ����
ʵ��������һδ֪Ũ�ȵ�ϡ���ᣬijѧ��Ϊ�ⶨ�����Ũ����ʵ�����н�������ʵ�飮�������������գ�
������100mL 0.10mol/L NaOH����Һ��
��ȡ20.00mL����ϡ���������ƿ�У����μ�2��3�η�̪��Һ��ָʾ�����õı�NaOH��Һ���еζ����ظ������ζ�����2��3�Σ���¼�������£�
ʵ���� | NaOH��Һ��Ũ�ȣ�mol/L�� | NaOH��Һ�������mL�� | ����������Һ�������mL�� |
1 | 0.10 | 20.00 | |
2 | 0.10 | 22.46 | 20.00 |
3 | 0.10 | 22.54 | 20.00 |
��1����1��ʵ��ζ�ǰҺ����0�̶ȣ��ζ�����ͼ��ʾ�����һ��ʵ��ζ�����ȥNaOH��Һ�������¼Ϊ_________mL���ζ��ﵽ�յ��������_____________________��
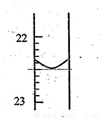
��2�������������ݣ��ɼ�����������Ũ��Ϊ___________��
��3��������ʵ���У����в�������ɲⶨ���ƫ�ߵ���___________
A���ζ��յ�ʱ���Ӷ���
B����ʽ�ζ���ʹ��ǰ��ˮϴ��δ�ô���ϡ������Һ��ϴ
C����ƿˮϴ��δ����
D������NaOH����Һ������ʱ����
E����ʽ�ζ��ܼ��첿�������ݣ��ζ�����ʧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��ӱ�ʡ�߶������л�ѧ���������棩 ���ͣ�ѡ����
ij�¶�����2L�ܱ������м���һ����A���������»�ѧ��Ӧ��2A(g)  B(g) + C(g)����H = -48.25 kJ.mol-1����Ӧ������B��A��Ũ�ȱ���ʱ��t��ͼ��ʾ��ϵ������õ�15minʱc(B)=1.6 mol.L-1�������н�����ȷ����
B(g) + C(g)����H = -48.25 kJ.mol-1����Ӧ������B��A��Ũ�ȱ���ʱ��t��ͼ��ʾ��ϵ������õ�15minʱc(B)=1.6 mol.L-1�������н�����ȷ����
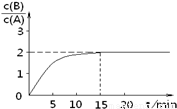
A�����¶��´˷�Ӧƽ�ⳣ��Ϊ3.2
B��A�ij�ʼ���ʵ���Ϊ4 mol
C����Ӧ�ﵽƽ��ʱ��A��ת����Ϊ80%
D����Ӧ�ﵽƽ��ʱ���ų���������193kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��ӱ�ʡ�߶������л�ѧ���������棩 ���ͣ�ѡ����
��֪��Ӧ��2CO(g)=2C(s)+O2(g)�����H�͡�S�����¶ȶ��䣬����˵������ȷ����
A�������������Է����� B�����������Է�����
C�������²����Է����У����������Է����� D���κ��¶��¶������Է�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꼪��ʡ��һ�����л�ѧ���������棩 ���ͣ������
�ڷ�Ӧ��3Cu+��HNO3(ϡ)�T3Cu(NO3)2+2NO��+4H2O�У�����д���е������� ��ͭ�Ǹ÷�Ӧ�� ��������19.2gͭ���������μӷ�Ӧ��HNO3�����ʵ����� mol������ԭ��HNO3�����ʵ����� mol��ת�Ƶ��ӵ���ĿΪ ����NA��ʾ�����õ����ű���÷�Ӧ�е���ת�Ƶķ������Ŀ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꼪��ʡ��һ�����л�ѧ���������棩 ���ͣ�ѡ����
�����ײ��ϡ���ָ���������ڼ�������ʮ���IJ��ϣ��罫�����ײ��ϡ��� ɢ��Һ���ɢ���У����û������е�������
ɢ��Һ���ɢ���У����û������е�������
A����ȫ������Ĥ B���ж����ЧӦ
C������Һ��һ���ܵ��� D����������һ��Ϊ��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ�人�����ѧУ��һ�����л�ѧ���������棩 ���ͣ�ѡ����
����������ײʱ����ȫ�����з�����Ӧ10NaN3+2KNO3 = K2O+5Na2O+16N2��������������Ȼ�ԭ�����1.75mol���������ж���ȷ���ǣ� ��
A������40.0LN2����״����
B����0��250molKNO3������
C��ת�Ƶ��ӵ����ʵ���Ϊ1.25mol
D����Ӧ�й�����0.625mol��������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com