
| c(标准)×V(标准) |
| V(待测) |
| c(标准)×V(标准) |
| V(待测) |
| aV |
| 10 |
| aV |
| 10 |
| 1.008g |
| 1.2g |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
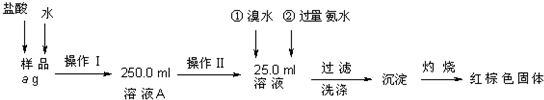
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
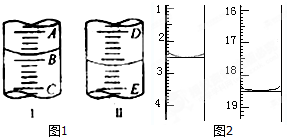
 某学习小组利用中和反应原理和DIS系统测定某氨水的物质的量浓度,以测量溶液导电能力来判断滴定终点.实验步骤如下:
某学习小组利用中和反应原理和DIS系统测定某氨水的物质的量浓度,以测量溶液导电能力来判断滴定终点.实验步骤如下:+ 4 |
+ 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
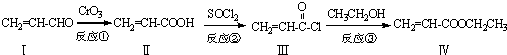
 也可与化合物Ⅲ发生类似反应③的反应,则得到的产物的结构简式为
也可与化合物Ⅲ发生类似反应③的反应,则得到的产物的结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、50 mL酸式滴定管;甲基橙 |
| B、50 mL碱式滴定管;酚酞 |
| C、50 mL量筒;石蕊 |
| D、50 mL酸式滴定管;不用指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
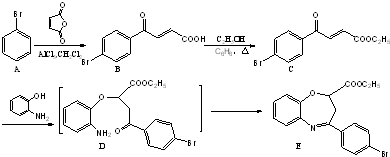
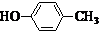
 和一种常见的有机物F,F的结构简式为
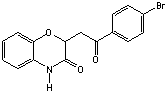
和一种常见的有机物F,F的结构简式为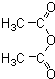
| H2O |
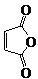 俗名“马莱酐”,它是马莱酸(顺丁烯二酸:)的酸酐.
俗名“马莱酐”,它是马莱酸(顺丁烯二酸:)的酸酐.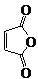 为原料制备化合物
为原料制备化合物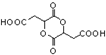 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:| 浓H2SO4 |
| 170℃ |
| Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

 ),请在方框内写出合成路线流程(无机试剂任选).注:合成路线流程的书写格式参照如下示例:
),请在方框内写出合成路线流程(无机试剂任选).注:合成路线流程的书写格式参照如下示例:| Cl2 |
| 光照 |
| NaOH/H2O |
| △ |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com