
 碳及其化合物在科技、社会生产、生活中有着广泛的应用.请按要求回答下列问题:
碳及其化合物在科技、社会生产、生活中有着广泛的应用.请按要求回答下列问题:| 温度/℃ | 600 | 750 | 900 | 1100 | 1250 |
| 平衡常数K | 2.5 | 1.6 | 1 | 0.9 | 0.6 |
| A | B | C | D | E | |
| n(CO2) | 3 | 1 | 0 | 1 | 1 |
| n(H2) | 2 | 1 | 0 | 1 | 2 |
| n(CO) | 1 | 2 | 3 | 0.5 | 3 |
| n(H2O) | 5 | 2 | 3 | 0.5 | 1 |
分析 (1)已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l)△H1=-1214.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H2=-566kJ•mol-1
依据盖斯定律计算,①+②得到,2CH4(g)+4O2(g)=2CO2(g)+4H2O(l)△H;
(2)①依据图中平衡常数随温度变化关系判断反应的热效应;
②CO2(g)+H2(g)?CO(g)+H2O(g)反应前后气体体积不变,改变压强平衡不移动,压强增大,容器体积减小,物质浓度增大,反应速率增大;
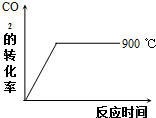
CO2(g)+H2(g)?CO(g)+H2O(g)△H<0,降低温度反应速率减慢,达到平衡用的时间变长,平衡正向移动,二氧化碳转化率提高,据此作图;
③依据图表数据可知900℃,平衡常数为:1,即c(CO2)•c(H2)=c(CO)•c(H2O),要使反应向正向进行则满足c(CO2)•c(H2)>c(CO)•c(H2O),根据乘积的比值判断反应方向;
CO2(g)+H2(g)?CO(g)+H2O(g)前后气体体积不变,恒温恒容建立等比等效,投料比与C相同时,
平衡后与C中各物质的百分含量相等;
(3)①先写出燃料电池的总反应式,再写出正极的电极反应式,做差得负极电极反应式;
②计算氧气的物质的量,进而计算生成二氧化碳的物质的量,根据n(KOH)与n(CO2)比例关系判断反应产物,进而计算溶液中电解质物质的量,结合盐类水解与电离等判断.
解答 解:(1):①2CH4(g)+3O2(g)=2CO(g)+4H2O(l)△H1=-1214.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H2=-566kJ•mol-1
依据盖斯定律计算,①+②得到,2CH4(g)+4O2(g)=2CO2(g)+4H2O(l)△H=-1780.6KJ/mol;
热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3 kJ•mol-1;
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3 kJ/mol;
(2)①化学平衡体系中升高温度平衡向吸热反应方向移动,依据图中数据可知,温度升高,平衡常数减小,可知正向为放热反应,逆向为吸热反应,所以该反应的△H<0;
②CO2(g)+H2(g)?CO(g)+H2O(g)反应前后气体体积不变,改变压强平衡不移动,压强增大,容器体积减小,物质浓度增大,反应速率增大;
CO2(g)+H2(g)?CO(g)+H2O(g)△H<0,降低温度反应速率减慢,达到平衡用的时间变长平衡正向移动,二氧化碳转化率提高,转化率随时间变化的示意图为: ;
;
故答案为:不变;增大; ;
;
③依据图表数据可知900℃,平衡常数为:1,即c(CO2)•c(H2)=c(CO)•c(H2O),要使反应向正向进行则满足c(CO2)•c(H2)>c(CO)•c(H2O),
A.3×2>1×5反应向着正向移动,故A正确;
B.1×1<2×2,反应向逆向进行,故B错误;
C.0×0<3×3,反应向逆向进行,故C错误;
D.1×1>0.5×0.5,反应向正向进行,故D正确;
E.1×2<3×1,反应向逆向进行,故E错误;
故选:AD;
CO2(g)+H2(g)?CO(g)+H2O(g)前后气体体积不变,恒温恒容建立等比等效,投料比与C相同时,
平衡后与C中各物质的百分含量相等,将各组物质转化为初始为二氧化碳和氢气投料,
C.n(CO2):n(H2)为:3:3=1:1;
A.n(CO2):n(H2)为:4:3与C组不相等,故A错误;
B.n(CO2):n(H2)为:3:3与C组不相等,故B正确;
D.n(CO2):n(H2)为:1.5:1.5与C组相等,故D正确;
E.n(CO2):n(H2)为:2:3与C组不相等,故E错误;
故选:BD;
故答案为;AD;BD;
(3)二甲醚、空气、KOH溶液为原料总电池反应方程式为:CH3OCH3+3O2+4OH-=2CO32-+5H2O ①
正极电极反应式为:3O2+6H2O+2e-=12e- ②
①-②得:CH3OCH3-12e-+16OH -=2CO32-+11H2O;
故答案为:CH3OCH3-12e-+16OH-=2CO32-+11H2O;
②参与反应的氧气在标准状况下体积为8960mL,物质的量为$\frac{6.72L}{22.4L/mol}$=0.3mol,根据电子转移守恒可知,生成二氧化碳为$\frac{0.3mol×4}{8}$=0.15mol;
;n(KOH)=0.1L×3.0mol•L-1=0.3mol,n(KOH):n(CO2)=0.3mol:0.15mol=2:1,
发生反应2KOH+CO2=K2CO3+H2O,二者恰好反应生成碳酸钾,在K2CO3溶液中K2CO3═2K++CO32-,CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,CO32-水解使溶液呈碱性,有c(OH-)>c(H+);由于CO3-少部分水解,有c(CO32-)>c(HCO3-),H CO3-又发生第二步水解,有c(OH-)>c(HCO3-),第二步水解较第一步水解弱的多,那么c(OH-)、c(H CO3-)相差不大,但c(H+)比c(OH-)小的多,因此c(OH-)>c(HCO3-),溶液中离子浓度大小为:c(K+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),
故答案为:c(K+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+).
点评 本题为综合题,涉及热化学方程式的书写,化学平衡常数的应用,等效平衡的判断,电池反应式的书写,离子浓度大小比较,明确盖斯定律计算反应热方法、化学平衡常数的应用、原电池工作原理、盐类水解规律是解题关键,题目难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 炼铁过程中的铁元素 | B. | 炼铁过程中的氧元素 | ||
| C. | 炼铁过程中的碳元素 | D. | 炼钢过程中的铁元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NH4HCO3稀溶液与过量的KOH溶液反应:NH4++HCO3-+2OH-→CO32-+NH3•H2O+H2O | |
| B. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-→2 Al(OH)3↓+3BaSO4↓ | |
| C. | 向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2→2 Fe3++2 Br2+6 Cl- | |
| D. | 醋酸除去水垢:2H++CaCO3→Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝及其合金使用广泛,是因为铝比铁更耐酸、碱的腐蚀 | |
| B. | 通过红外光谱分析可以区分乙醇与乙酸乙酯 | |
| C. | 大部分金属的冶炼都是通过在高温下发生的氧化还原反应实现的 | |
| D. | 通常所说的三大合成材料是指塑料、合成橡胶和合成纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锅炉水垢用饱和纯碱溶液浸泡,即可除去 | |
| B. | 向淀粉水解后的溶液中滴加碘水,即可检验淀粉是否水解完全 | |
| C. | 向C2H5X消去反应后的溶液中滴加硝酸银溶液,即可检验卤原子X的种类 | |
| D. | 将25 g CuSO4•5H2O溶于100 mL水中,可配得100 mL1.0 mol/L CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与漂白粉溶液反应的离子方程式:Ca2++SO32-=CaSO3↓ | |
| B. | 通入HCl至溶液pH=7:c(Na+)=2c(SO32-)+c(HSO3-)+c(Cl-) | |
| C. | 加入NaOH固体可使溶液中水的电离程度增大 | |
| D. | 通入SO2至过量:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煎炸食物的花生油和牛油都是可皂化的饱和酯类 | |
| B. | 制饭勺、饭盒、高压锅等的不锈钢是合金 | |
| C. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| D. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)在425℃、A12O3作催化剂,甲醇与氨气反应可以制得二甲胺(CH3)2NH.二甲胺显弱碱性,与盐酸反应生成(CH3)2NH2Cl,溶液中各离子浓度由大到小的顺序为c(Cl-)>c[(CH3)2NH2+]>c(H+)>c(OH-).
(1)在425℃、A12O3作催化剂,甲醇与氨气反应可以制得二甲胺(CH3)2NH.二甲胺显弱碱性,与盐酸反应生成(CH3)2NH2Cl,溶液中各离子浓度由大到小的顺序为c(Cl-)>c[(CH3)2NH2+]>c(H+)>c(OH-).查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com