
(1)腐蚀铜箔线路的化学方程式是________。
(2)为了从使用过的废腐蚀液中回收铜,并重新制得纯净的FeCl3溶液,拟采用下列实验步骤,请在各步骤的空格中,填写适当的试剂或生成物的化学式,使实验能达到预期的效果。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:




查看答案和解析>>
科目:高中化学 来源:高中化学同步单元练习册 全册 高二年级 题型:043
电子工业常用30%的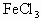 溶液腐蚀敷有铜箔的绝缘板,制成印刷线路板.这其中发生的离子方程式为________.
溶液腐蚀敷有铜箔的绝缘板,制成印刷线路板.这其中发生的离子方程式为________.
为了从使用过的废腐蚀液中回收铜,并制得纯净的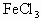 溶液,拟采用下列实验.请在各步骤的空格中填写适当的化学式以达实验目的.
溶液,拟采用下列实验.请在各步骤的空格中填写适当的化学式以达实验目的.
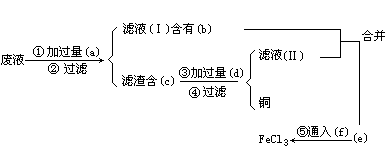
(a)________,(b)________,(c)________,(d)________,(e)________,(f)________.
查看答案和解析>>
科目:高中化学 来源:2010年浙江省高考化学冲刺试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com