
| A. | Q2<$\frac{{Q}_{1}}{2}$ | B. | Q2>$\frac{{Q}_{1}}{2}$ | C. | Q2=$\frac{{Q}_{1}}{2}$ | D. | 不能确定 |
分析 2SO2(g)+O2(g)?2SO3(g)△H=-Q1KJ/mol,表示在上述条件下2mol SO2和1molO2完全反应生成1molSO3气体放出热量为Q1kJ,再结合可逆反应中反应物不能完全反应解答.
解答 解:热化学方程式:2SO2(g)+O2(g)?2SO3(g)△H=-Q1kJ/mol,表示在上述条件下2mol SO2和1molO2,完全反应生成1molSO3气体放出热量为Q1kJ,可逆反应中反应物不能完全反应,故向密闭容器中通入1molSO2和0.5molO2,参加反应是二氧化硫的物质的量小1mol,故平衡时放出的热量小于$\frac{Q{\;}_{1}}{2}$kJ,即Q2<$\frac{Q{\;}_{1}}{2}$,故选:A.
点评 本题考查可逆反应特点、热化学方程式等,难度不大,理解热化学方程式表示的含义是解题关键.


科目:高中化学 来源: 题型:解答题
| 反应物 | 催化剂 | 温度 | |
| ① | 10mL10% H2O2溶液 | 无 | 25℃ |
| ② | 10mL20% H2O2溶液 | 无 | 25℃ |
| ③ | 10mL20% H2O2溶液 | 无 | 40℃ |
| ④ | 10mL20% H2O2溶液 | 1~2滴0.1mol/LFeCl3溶液 | 40℃ |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
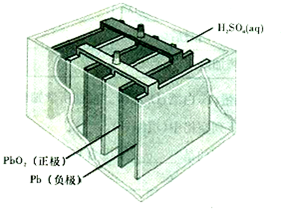
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
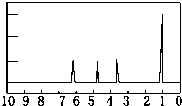 有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠的金属活泼性大于铜,在溶液中钠可以置换出铜 | |
| B. | 在稀硫酸中加入铜粉,铜粉不溶解,再加入KNO3固体,铜粉仍不溶解 | |
| C. | 在KI溶液中加入NaNO3,没有明显现象,加入盐酸,即有I2生成 | |
| D. | 纯锌与稀硫酸反应产生氢气的速率较,加入少量CuSO4固体,速率不改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ①③⑤ | C. | ①②⑤ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用系统命名:CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 | |
| B. | 2-甲基戊烷和2,2-二甲基丁烷互为同分异构体,C2H6和C3H8一定互为同系物 | |
| C. | 将(NH4)2SO4、CuSO4溶液分别加入蛋白质溶液,都出现沉淀,表明二者均可使蛋白质变性 | |
| D. | 糖类、油脂和蛋白质均可发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
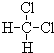 和
和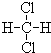 ;
;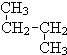 和
和 ⑦CH3 (CH2) 3CH3和
⑦CH3 (CH2) 3CH3和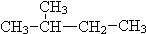
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com